
下列各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )
| X | Y | Z |
A | CO2 | SO2 | 饱和Na2CO3溶液 |
B | HCl | Cl2 | 饱和NaCl溶液 |
C | Fe2O3 | Al2O3 | NaOH溶液 |
D | Na2SO4溶液 | Na2CO3 | 盐酸 |
科目:高中化学 来源:2017届天津市五区县高三上学期期末考试化学试卷(解析版) 题型:简答题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题:

(1)W在周期表中的位置是___________,Y、Z的离子半径由大到小的顺序为___________ (用元素符号表示);由X与氢元素组成四原子化合物的电子式为__________。
(2)下列说法正确的是____________。
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80 mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作Ⅱ:再加入一定量的Na2S2O3溶液。(已知:2S2O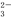 +I2=S4O
+I2=S4O +2I-)
+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:
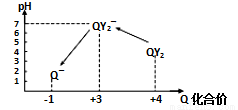
①操作Ⅰ中反应的离子方程式是_________________________。
②确定操作Ⅱ完全反应的现象是_________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是______________________。
④若水样的体积为1.0 L,在操作Ⅱ中消耗了1.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是_______________mg·L-1(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:选择题
下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是

A.(4)>(2)>(1)>(3)
B.(2)>(1)>(3)>(4)
C.(4)>(2)>(3)>(1)
D.(3)>(2)>(4)>(1)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省定西市通渭县高二上学期期末化学试卷(解析版) 题型:选择题
常温下的下列各种溶液中,可能大量共存的离子组是( )
A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3-
D.c(H+)=10-14mol·L-1的溶液中:Mg2+、NO3-、Fe2+、ClO-
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷(解析版) 题型:实验题
I.喷泉是一种常见的自然现象,其产生的原因是存在压强差。

(1)实验室制取氨气的化学方程式____ __。
①用图1装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是___________。
②如果只提供如图2的装置, (“能”或“不能”)实现喷泉实验
(2)利用图3装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________。
A.Cu与稀盐酸 B.NaHCO3溶液与NaOH溶液
C.CaCO3与稀H2SO4D.NH4HCO3与稀盐酸
(3)在图4锥形瓶中加入酒精,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是________。
A.浓硫酸 B.食盐
C.硝酸钾 D.硫酸铜

(4)从产生喷泉的原理分析,图 是减小上部烧瓶内的压强。图 是增大下部锥形瓶内气体的压强。人造喷泉及火山爆发的原理与上述装置图________原理相似。(均填序号)
II.某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为
① ;② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
Na2O2 + HCl ----- Cl2 + NaCl +
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出一个要点即可)。
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
物质 组别 | 甲 | 乙 | 丙 |
A | Mg | FeSO4 | O2 |
B | Cl2 | H2O | NH3 |
C | Fe | H2O | FeCl3 |
D | NaHCO3 | Ca(OH)2 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷(解析版) 题型:选择题
下列说法中错误的是
A. 硅胶可用作干燥剂和催化剂的载体
B. 水玻璃可用作制硅胶和木材防火剂
C. 节日里燃放的焰火,是某些金属元素的焰色反应所呈现出来的色彩
D. 光束通过稀豆浆时不会产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一12月月考化学卷(解析版) 题型:选择题
将15ml 2mol/L Na2CO3溶液逐滴加入到40ml0.5mol/L MCln盐酸溶液中,恰好将溶液中的 Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4 B.3 C.2 D.1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市部分区高一上学期期末化学试卷(解析版) 题型:实验题
某同学设计如图装置,研究非金属元素性质变化规律。

(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,强酸一般能制取弱酸。现有硝酸溶液、碳酸钙、澄清 石灰水、硅酸钠溶液,选择所给试剂,用如上图装置来证明酸性:HNO3>H2CO3>H2SiO3。(不考虑硝酸的挥发性)
石灰水、硅酸钠溶液,选择所给试剂,用如上图装置来证明酸性:HNO3>H2CO3>H2SiO3。(不考虑硝酸的挥发性)
A、B、C中盛装的试剂分别为____________、____________、____________。C中实验现象为____________________;
写出C中发生反应的离子方程式:____________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用上图装置证明氯气氧化性强于碘单质的氧化性。A中盛装浓盐酸,B中装入高锰酸钾粉末,实验时C中溶液变成蓝色,则:C中盛装的试剂为_________________;写出C中离子方程式_____________________。该实验该装置有明显不足,请指出改进方法:__________________________。
(3)如果C中盛装饱和氢硫酸(H2S饱和水溶液),A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀。写出该反应的化学方程式:_____________;如果将SO2气体 通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2 (填序号)。
通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2 (填序号)。
A.漂白性 B.氧化性 C.还原性 D.酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com