
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol·L-1。
阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
① 用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
② 取少量溶液,加入KSCN溶液无明显变化。
③ 另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④ 向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是______,一定不含的阴离子是_______(写离子符号)。
(2)③中加入少量盐酸生成无色气体的的离子方程式是_____________,
④中生成白色沉淀的离子方程式是_______________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为_________。
(4)甲同学最终确定原溶液中所含阳离子是_________,阴离子是________。(写离子符号)
科目:高中化学 来源:2016-2017学年江苏省高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
一定条件下,浓H2SO4能与多种非金属单质反应,如:S+2H2SO4(浓) 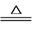 3SO2↑+2H2O。下列有关该反应的说法正确的是
3SO2↑+2H2O。下列有关该反应的说法正确的是
A. S是氧化剂 B. S得到电子
C. 浓H2SO4发生还原反应 D. 1molH2SO4转移电子的数目为4mol
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 在相同条件下PH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,水的电离程度前者比后者大
B. 反应NH3(g)+HCl(g)  NH4Cl(s)能自发进行,则该反应ΔH>0
NH4Cl(s)能自发进行,则该反应ΔH>0
C. 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了c(H+)
D. 一定条件下,反应2SO2(g)+O2(g)  2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:选择题
下列有关实验安全的说法不正确的是:
A. 不慎将试验台上的酒精灯碰翻着火时,立即用湿抹布盖灭
B. 不慎将浓硫酸沾到皮肤上,应迅速用水冲洗,再涂上稀NaHCO3溶液
C. 如果将苯酚溶液沾到皮肤上,应立即用酒精或NaOH溶液擦洗
D. 若不慎将水银温度计打碎时,应立即撒上一层硫粉
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:选择题
下列试剂的存放方法正确的是:
A. 浓硝酸存放在棕色广口试剂瓶中 B. 盛溴的试剂瓶里加少量水以减少溴的挥发
C. 少量白磷存放在煤油或CC14中 D. 碘单质可以保存在无色广口瓶中
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A. 混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B. 混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C. c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D. c(Na+)=c(Y-)+c(HY)="0.3" mol/L
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
某温度下,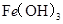
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液 ,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是

A. 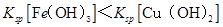
B. 加适量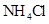 固体可使溶液由
固体可使溶液由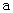 点变到
点变到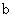 点
点
C. 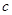
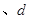 两点代表的溶液中
两点代表的溶液中 与
与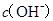 乘积相等
乘积相等
D. 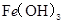 、
、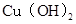 分别在
分别在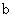 、
、 两点代表的溶液中达到饱和
两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. HF比H2O稳定性更强,是由于HF分子间作用力较大
B. CCl4、N2和SiO2晶体中,各原子最外层都达到8电子稳定结构
C. Na投入到水中,有共价键的断裂与形成
D. 离子化合物中一定含有离子键,可能含有共价键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:实验题
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
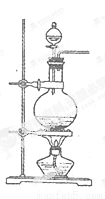
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3) = 2.8×10-9、Ksp(MnCO3) = 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。

(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com