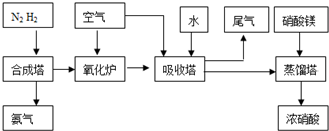
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)某温度下体积为200L的氨合成塔中,测得如下数据:
| 时间(h)浓度(mol/L) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.500 |
1.400 |
1.200 |
C1 |
C1 |
| H2 |
4.500 |
4.200 |
3.600 |
C2 |
C2 |
| NH3 |
0 |
0.200 |
0.600 |
C3 |
C3 |
根据表中数据计算0~2小时内N
2的平均反应速率
0.15
0.15
mol?L
-1?h
-1若起始时与平衡时的压强之比为a,则N
2的转化率为
(用含a的代数式表示)
(2)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法(Science,2,Oct.1998,p98),在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式
N2+6H++6e-═2NH3
N2+6H++6e-═2NH3
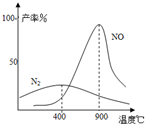
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH
3+5O
2?4NO+6H
2O K
1=1×10
53(900℃)
4NH
3+3O
2?2N
2+6H
2O K
2=1×10
67(900℃)温度较低时以生成
N2
N2
为主,温度高于900℃时,NO产率下降的原因
生成NO的反应为放热反应,升高温度转化率下降
生成NO的反应为放热反应,升高温度转化率下降
.吸收塔中需要补充空气的原因
进一步与NO反应生成硝酸
进一步与NO反应生成硝酸
.
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%.其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO
2和N
2请写出有关反应化学方程式
NO+NO2+H2O=2HNO2
NO+NO2+H2O=2HNO2
,
CO(NH2)2+2HNO2=CO2+2N2+3H2O
CO(NH2)2+2HNO2=CO2+2N2+3H2O
.

 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
 2NH3(g),物质的量减少△n
2NH3(g),物质的量减少△n