
【题目】海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如图:
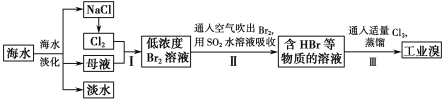
(1)请列举海水淡化的两种方法:___、___。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、___、___。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是___。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:___。
【答案】蒸馏法 电渗析法 Cl2 NaOH 富集溴元素 SO2+Br2+2H2O=4H++SO42-+2Br-
【解析】
通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2。
(1)海水淡化有蒸馏法、电渗析法、离子交换法等,故答案为:蒸馏法;电渗析法;
(2)电解NaCl溶液可以生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,由方程式可知电解可以获得氯气和氢氧化钠,故答案为:Cl2;NaOH;
2NaOH+Cl2↑+H2↑,由方程式可知电解可以获得氯气和氢氧化钠,故答案为:Cl2;NaOH;
(3)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是增大溶液中Br-的浓度,富集溴元素,故答案为:富集溴元素;
(4)在水溶液里溴和二氧化硫反应生成硫酸和氢溴酸,反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。
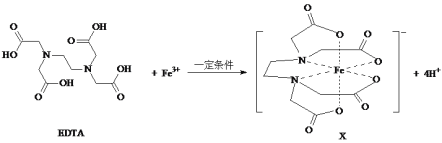
(1)EDTA中碳原子杂化轨道类型为_________________;EDTA中四种元素的电负性由小到大的顺序为__________________。
(2)Fe3+基态核外电子排布式为_________________。
(3)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6 ℃)比正二十一烷的沸点(100 ℃)高的原因是_________。
(4)1 mol EDTA中含有σ键的数目为______________。
(5)X中的配位原子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如图所示的变化:
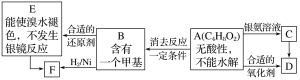
则A的结构简式是
A.HOCH2CH=CHCHO
B.CH3CH2COOCH3
C.CH3CH(OH)CH2CHO
D.HOCH2CH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普罗帕酮为广谱高效抗心律失常药,它可由有机物X经多步反应合成:
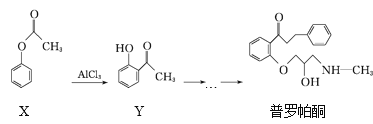
下列有关说法正确的是
A.在有机物X的1H核磁共振谱图中,有3组特征峰
B.可用溴水或FeCl3溶液鉴别X和Y
C.普罗帕酮分子中有1个手性碳原子
D.普罗帕酮能发生加成、水解、氧化、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
Cu2O+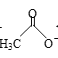
![]()
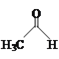
![]()

![]()

(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为___。
(3)CH3CHO分子中氧原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
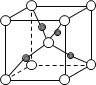
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构如图所示。已知总反应为C6H12O6+6O2===6CO2+6H2O,关于该电池的叙述正确的是

A.a电极反应:O2+2H2O+4e-===4OH-
B.O2在a电极被氧化
C.b电极反应:C6H12O6+6H2O-24e-===6CO2+24H+
D.该电池能够在高温下工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:
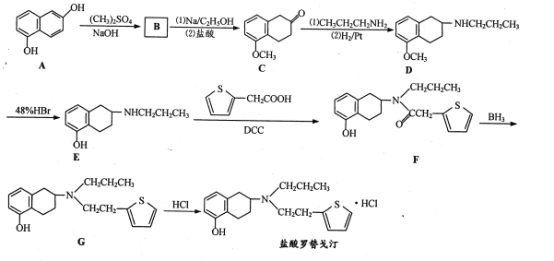
(1) 、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
(2)D→E的反应类型是_______。
(3)B的分子式为C12H12O2,写出B的结构简式;____ 。
(4)C的一种同分异构体X同时满足下列条件,写出X的结构简式:_______。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:![]()
![]() R3COOH+
R3COOH+![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备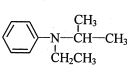 的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+→Cu2++2Fe2+
B.Na2O2与H2O反应制备O2:Na2O2+H2O→2Na++2OH-+O2↑
C.将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO-
D.铁与盐酸反应:2Fe + 6H+→2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种高效、低耗、污染小的清洁能源。下列说法正确的是( )
①甲烷是一种正四面体结构的分子
②物质的量1:1的甲烷与氯气发生取代反应时,生成物只有CH3Cl和HCl
③0.5 mol甲烷完全燃烧时消耗氧气最多为1 mol
④1 mol甲烷全部生成CCl4,最多消耗2 mol氯气
A.①②B.①③C.②④D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com