
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )

A. 消耗22.4 LCO2可制得1mol乙酸
B. 该反应过程符合“绿色化学”原理,其原子利用率为100%
C. 该反应属于取代反应
D. 反应物和生成物中均含有极性键和非极性键
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高二上学期期末考试化学试卷(解析版) 题型:简答题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。

请回答下列问题:
(1)甲池为___________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为____________________。
(2)丙池中F电极为___________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为___________________。
(3)当乙池中C极质量减轻5.4g时,甲池中B电极理论上消耗O2的体积为________ml(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是________(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(0H)2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高一上学期期末考试化学试卷(解析版) 题型:选择题
由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是( )
A. 锌 B. 铁 C. 铝 D. 镁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高一上学期期末考试化学试卷(解析版) 题型:选择题
将蔗糖用少量水湿润,然后在不断搅拌下加入浓硫酸,可看到蔗糖颜色变黑,体积逐渐膨胀,最后变成多孔的疏松固体,且产生刺激性气味的气体,上述过程中( )
A. 体现浓硫酸的吸水性 B. 体现了浓硫酸的脱水性
C. 体现了浓硫酸的吸水性和脱水性 D. 体现了浓硫酸的吸水性、脱水性和强氧化性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:填空题
氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g)  2NO(g) ΔH = +183 kJ/mol
2NO(g) ΔH = +183 kJ/mol
2H2(g) + O2(g) === 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) === 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g)  2NH3(g) ΔH = ___________ kJ/mol
2NH3(g) ΔH = ___________ kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
① 按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=_________________(只需代入数据,不用计算结果)
② 按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式:________________________
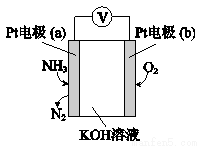
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:选择题
一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的有几组( )
序号 | X | Y | Z |
① | NaHSO4溶液 | Al(OH)3 | 稀硫酸 |
② | CaCl2溶液 | SO2 | CaSO3 |
③ | HF溶液 | Si | Ba(OH)2 |
④ | Fe Cl3溶液 | Fe | 浓硝酸 |
A. 1组 B. 2组 C. 3组 D. 4组
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:填空题
认真观察下列装罝,回答下列问题:

(1)装置B中Cu上发生的电极反应方程式为__________________________;电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________ 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
b.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、 Cl-几乎都不移动
(2)装置A中总反应的离子方程式为________________________。
(3)若装置E的目的是在Cu材料上镀银,则X为___________,极板N的材料为___________;若装置E的目的是电解精炼铜,则极板___________(填“M”或“N”)的材料为粗铜板(含少量锌、金和银),该电极发生的电极反应式为___________。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为_______L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100 mL 2 mol/L的盐酸跟锌片反应时,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 反应KClO3+6HCl=3Cl2+KCl+3H2O,每生成1.5molCl2转移电子数为2.5NA
B. 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
C. 1L 0.1 mol•L-1NH4Cl溶液中NH4+的数目为0.1NA
D. 40gSiC中含有Si—C键的数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com