
����Ŀ��﮶��ε�����������ϵ�̽�����о���﮵�صķ�չ�dz��ؼ���
(1) �����ؾ��������ѭ���ȶ��ԡ�
����������Se����SO2ͨ��������(H2SeO3)��Һ��Ӧ�Ƶã���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��һ�������طŵ�ʱ�Ĺ���ԭ����ͼ1��ʾ��д�������ĵ缫��Ӧʽ��________________�����ʱLi����________(����Se������Li��)��Ǩ�ơ�
�� Li2Sex������̼������ʱ�������仯��ͼ2��ʾ��ͼ��3��Li2Sex��̼����Ľ�������ɴ�С��˳����________��
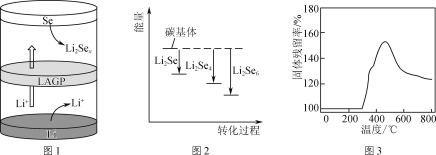
(2) Li2S��ص����������ܶȸߣ�����������Ϊ̼���������(Li2S)��
�� Li2S�����������Ǿ��Ǹ������Ƶã����пǾ��ǵ�������________��
��ȡһ����Li2S��Ʒ�ڿ����м��ȣ������Ʒ������������¶ȵı仯��ͼ3��ʾ��(��������ʣ�![]() ��100%)����300 ����������ʱ仯��ԭ����________��
��100%)����300 ����������ʱ仯��ԭ����________��
���𰸡�H2SeO3��2SO2��H2O===Se��2H2SO4 2Li����xSe��2e��===Li2Sex Li Li2Se6>Li2Se4>Li2Se �ṩ̼Դ��������﮻�ԭ(����ԭ��) 300 �����Ʒ��Ҫ����������Ӧ���̣���Ӧ1ΪLi2S��O2��������Li2SO4����Ӧ2ΪC��O2��������CO2��ǰ�ڹ�����������ӵ�ԭ���Ƿ�Ӧ1Ϊ�������ڹ�������ʼ��ٵ�ԭ��Ӧ2Ϊ��
��������
(1)��SO2ͨ����ϡ��������Se������������ԭ��Ӧ����ѧ����ʽΪ��![]() ��
��
���ɵ�ع�����ԭ��ͼ��֪��Li�缫Ϊ��صĸ�����Se�缫Ϊ��ص���������طŵ�ʱLi+��Ǩ�Ƶ�����������Se�������![]() ����������ĵ缫��ӦʽΪ��
����������ĵ缫��ӦʽΪ��![]() ������ڳ��ʱ��Li�缫�����Դ�ĸ�������������Li+���������ڵ����г�����Ǩ�ƣ����Li+�ڳ��ʱ��Li�缫Ǩ�ƣ�
������ڳ��ʱ��Li�缫�����Դ�ĸ�������������Li+���������ڵ����г�����Ǩ�ƣ����Li+�ڳ��ʱ��Li�缫Ǩ�ƣ�
����ͼ��֪��![]() ������̼������ʱ�������ͷ�����������ͷŵ�����Խ����ô���֮��Խ�ȶ������3��
������̼������ʱ�������ͷ�����������ͷŵ�����Խ����ô���֮��Խ�ȶ������3��![]() ��̼������������ǿ��Ϊ
��̼������������ǿ��Ϊ![]() ��
��
(2)��Li2S��ص�����������̼������Li2S�����Ϊ�˻�������������ϣ�����Ҫ�Ǿ�����������﮸��·�Ӧʱ��һ���潫����﮻�ԭ����һ�����ṩ����Li2S��̼Դ��
�ڸ�Li2S�Ǿ���̼�����ṹ��Li2S������ڿ�������������仯ʱ��һ����Ҫ����Li2S������������Ӱ�죬��һ����ҲҪ���ǰ���Li2S��̼�ڸ����±�������Ӱ�죻����300 �����Ʒ��Ҫ����������Ӧ���̣���Ӧ1ΪLi2S��O2��������Li2SO4����Ӧ2ΪC��O2��������CO2��ǰ�ڹ�����������ӵ�ԭ���Ƿ�Ӧ1Ϊ�������ڹ�������ʼ��ٵ�ԭ���Ƿ�Ӧ2Ϊ����


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������廷������ȫ��������������Ž���һ�����и����е����ʣ���������ͼ����Ӱ���ֹ�ϵ����(����)
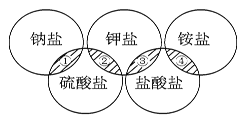
�� | �� | �� | �� | |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | Na2SO4 | K2SO4 | KCl | NH4Cl |
C | NaCl | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪CO(g)��2H2(g)![]() CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��
CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��

A.�÷�Ӧ����H����91 kJ��mol��1
B.����������÷�Ӧ����H��С
C.��Ӧ��������������������������
D.����÷�Ӧ����Һ̬CH3OH������H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ������£�
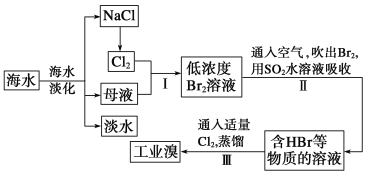
��1�����оٺ�ˮ���������ַ�����__________________________��__________________________��
��2�����������ѻ��Br2�����������ֽ�Br2��ԭΪBr������Ŀ����__________________________��
��3����������SO2ˮ��Һ����Br2�������ʿɴ�95%���йط�Ӧ�Ļ�ѧ����ʽΪ_________________�� �ɴ˷�Ӧ��֪�������������⣬�ڹ�ҵ������Ӧ�������Ҫ������__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1L�ĺ����ܱ������У�����������Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺2H2O(g)![]() 2H2(g)+O2(g) ��H>0��ˮ������Ũ��c��ʱ��t�ı仯���±���ʾ��
2H2(g)+O2(g) ��H>0��ˮ������Ũ��c��ʱ��t�ı仯���±���ʾ��
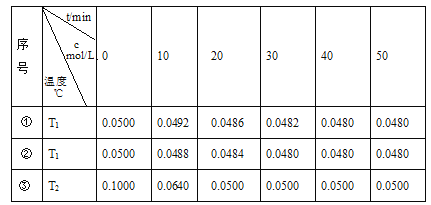
��1���Ա�ʵ����¶ȣ�T2_________T1�����������������=����
��2��������Ч�ʣ�ʵ���________ʵ��ڣ������������
��3����ʵ��۴ﵽƽ��״̬�����������ͨ��ˮ������������0.1mol����Ӧ�ٴδﵽƽ��ʱ����ȷ����ѧ��Ӧ���еķ���_________________���������Ӧ��Ӧ���С������淴Ӧ������С���ƽ�ⲻ�ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������������漰�ķ�Ӧ���£�
Na2Cr2O7��2C![]() Cr2O3��Na2CO3��CO��
Cr2O3��Na2CO3��CO��
Cr2O3��2Al![]() 2Cr��Al2O3
2Cr��Al2O3
(1) Cr��̬ԭ�ӵĺ�������Ų�ʽΪ________��
(2) Na��O��C�ĵ�һ�����ܴӴ�С��˳��Ϊ________��
(3) ��CO![]() ��Ϊ�ȵ������һ�ַ���Ϊ________(�ѧʽ)��
��Ϊ�ȵ������һ�ַ���Ϊ________(�ѧʽ)��
(4) Cr2O3�������ԣ�����NaOH��Һ�γ������Na[Cr(OH)4]��
Na[Cr(OH)4]������Ļ�ѧʽΪ____________��1 mol��������к�������ĿΪ_________��
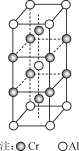
(5) �Ͻ�CrAl����ľ�������ͼ��ʾ��д���úϽ�Ļ�ѧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ��ˮ��ͨ��������Cl2+H2O===2H+ + ClO+ Cl
B. ��Ca(HCO3)2��Һ�еμ�����NaOH��Һ��Ca2+ + 2HCO3+2OH===CaCO3��+CO32+2H2O
C. ��������Һ�мӹ�����ˮ��Al3++4NH3��H2O===AlO2+4NH4++2H2O
D. ��Fe2O3�ܽ�������HI��Һ��Fe2O3+6H+===2Fe3++3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨп�̵��Ͳ��������Ҫ�ɷ�ΪMnO2��NH4Cl��ZnCl2�ȡ�ij�о�С��̽�����ڵ���ڵĺ�ɫ���岢��������ʱ��������ͼ��ʾʵ�顣�����й�ʵ���������ȷ����
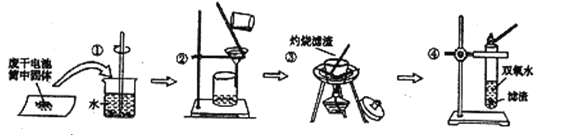
A. �������в�������������ת�ƹ��� B. ������Ϊ�������õ�����Һ�Լ���
C. ��������ʢ��ҩƷ������������ D. ��������Ŀ���dz�ȥ�����е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ��H=��190kJ/mol������˵����ȷ����
O2(g)=CO2(g)+2H2(g) ��H=��190kJ/mol������˵����ȷ����
A.CH3OH��ȼ����Ϊ190kJ/mol
B.�÷�Ӧ˵��CH3OH��H2�ȶ�
C.��Ӧ�е������仯�뷴Ӧ��ϵ���¶Ⱥ�ѹǿ��
D.CO2(g)+2H2(g)=CH3OH(g)+![]() O2(g) ��H=+190kJ/mol
O2(g) ��H=+190kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com