
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH<0
CH3OH(l)+H2O(l) ΔH<0
①该反应自发进行的条件是___(填“低温”“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是___(填字母)。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3 molH—H键断裂
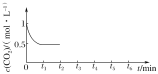
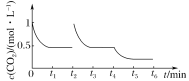
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,
t4时降低温度,t5时达到平衡,请画出t2~t6时间段CO2浓度随时间的变化___。
(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ: 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ: 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡时CH3OH的浓度c(Ⅰ)___c(Ⅱ)(填“>”“<”或“=”)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=___。在其他条件不变的情况下,若30 min时只改变温度至T2℃,此时H2的物质的量为3.2mol,则T1___(填“>”“<”或“=”)T2。若30min时只向容器中再充入1 molCO2(g)和1molH2O(g),则平衡___(填“正向”“逆向”或“不”)移动。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
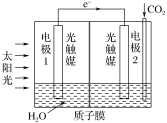
①电极2的电极反应式是____;
②在标准状况下,当电极2室有11.2LCO2反应。理论上电极1室液体质量___(填“增加”或“减少”)___g。
【答案】4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1100.2kJ·mol-1 低温 de 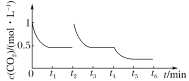 < 0.025mol·L-1·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
< 0.025mol·L-1·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
【解析】
根据题意可知,本题考查热化学方程式的书写、化学平衡移动、化学反应速率、电化学知识,运用盖斯定律、勒夏特列原理、![]() 、电化学原理分析。
、电化学原理分析。
Ⅰ.H2的燃烧热为285.8kJmol1,则①.2H2(g)+O2(g)=2H2O(l) △H=571.6kJmol1,②.N2(g)+2O2(g)=2NO2(g) △H=+133kJmol1③.H2O(g)=H2O(l) △H=44kJmol1根据盖斯定律①×2②③×4可得:4H2(g)+2NO2(g)=N2(g)+4H2O(g),则:△H=2×(571.6kJmol1)133kJmol14×(44kJmol1) = 1100.2kJmol1,故反应热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=1100.2kJmol1,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=1100.2kJmol1;
Ⅱ. (1)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△HT△S<0
故答案为:低温;
②a.甲醇、水为液体,CO2、H2的起始物质的量之比为1:3,反应按物质的量1:3反应,故混合气体中CO2、H2的起始物质的量之比为1:3,平均摩尔质量数值或平均相对分子质量始终保持不变,无法判断是平衡状态,故a错误;
b.由a中分析,可知CO2和H2的体积分数数值始终保持不变,无法判断是平衡状态,故b错误;
c.由a中分析,可知CO2和H2的转化率始终相等,无法判断是平衡状态,故c错误;
d.容器容积不变,混合气体质量减小,随反应进行混合气体密度减小,当混合气体的密度不变,反应到达平衡,故d正确;
e.1molCO2生成的同时有3molHH键断裂,而1molCO2生成的同时生成3molHH键,氢气的生成速率与消耗速率相等,反应到达平衡,故e正确,
故答案为:de;
③t2时CO2浓度为0.5mol/L,则氢气浓度变化量为(1mol/L0.5mol/L)×3=1.5mol/L,氢气平衡浓度为![]() 1.5mol/L=1.5mol/L,则该温度下平衡常数
1.5mol/L=1.5mol/L,则该温度下平衡常数![]() ,在t2时将容器容积缩小一倍,瞬间CO2浓度变为1mol/L,压强增大,平衡向正反应方向移动,t3时达到平衡时,等效为开始体积缩小一倍到达的平衡,设此时CO2浓度为xmol/L,则:
,在t2时将容器容积缩小一倍,瞬间CO2浓度变为1mol/L,压强增大,平衡向正反应方向移动,t3时达到平衡时,等效为开始体积缩小一倍到达的平衡,设此时CO2浓度为xmol/L,则:
CO2(g)+3H2(g)CH3OH(l)+H2O(l)
开始(mol/L): 2 6
转化(mol/L): 2x 63x
平衡(mol/L) :x 3x
则![]() ,解得x=0.5,
,解得x=0.5,
t3时达到平衡时CO2浓度为0.5mol/L,t4时降低温度,瞬间CO2浓度不变,正反应为放热反应,而后平衡向正反应移动,CO2浓度减小,画出t2t6CO2的浓度随时间的变化如图:
 。
。
故答案为:  ;
;
故答案为:<;
②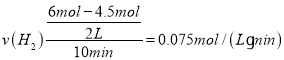 ,速率之比等于化学计量数之比,v(CH3OH)=
,速率之比等于化学计量数之比,v(CH3OH)=![]() v(H2)=0.025mol/(Lmin);20min时,转化的CO2为2mol1mol=1mol,则生成的CH3OH为1mol,而30min时CH3OH为1mol,故20min时已达平衡,
v(H2)=0.025mol/(Lmin);20min时,转化的CO2为2mol1mol=1mol,则生成的CH3OH为1mol,而30min时CH3OH为1mol,故20min时已达平衡,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
开始(mol/L): 2 6 0 0
转化(mol/L): 1 3 1 1
平衡(mol/L): 1 3 1 1
故平衡常数 ,
,
平衡时氢气为6mol1mol×3=3mol,氢气平衡浓度为![]() ,在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,平衡逆向移动,氢气浓度增大,由于正反应为放热反应,可以升高温度,即T1<T2;对反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),此时浓度商
,在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,平衡逆向移动,氢气浓度增大,由于正反应为放热反应,可以升高温度,即T1<T2;对反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),此时浓度商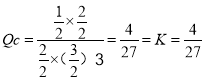 ,则平衡不移动;
,则平衡不移动;
故答案为:0.025mol/(Lmin);<;不;
(3)①电极2是正极,正极上二氧化碳得电子和氢离子反应生成HCOOH,电极反应式为CO2+2H++2e=HCOOH,
故答案为:CO2+2H++2e=HCOOH;
②电极1式为负极,发生的电极反应式为2H2O4e=4H++O2↑,理论上随着当电极2室有11.2L CO2反应,二氧化碳的物质的量为![]() ,转移电子为0.5mol×2=1mol,电极1室参加反应的水的质量为18g/mol×
,转移电子为0.5mol×2=1mol,电极1室参加反应的水的质量为18g/mol×![]() =9g,即电极1室理论减小液体质量为9g,
=9g,即电极1室理论减小液体质量为9g,
故答案为:减小;9。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列对于反应:![]() 的说法正确的是( )
的说法正确的是( )
A.氧化剂与还原剂的质量比为1:2
B.![]() 是氧化剂,水是还原剂
是氧化剂,水是还原剂
C.生成![]() 则有
则有![]() 电子发生转移
电子发生转移
D.氧化产物与还原产物的物质的量比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
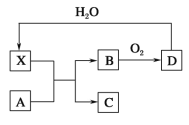
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可观察到有白色沉淀产生
D.由B转化为D的反应是工业制备X过程中的重要反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500g。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数___(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积___(填“偏大”、“偏小”或“无影响”)。
对滴定结果的分析最终都是由___的变化来分析C测变化。
③滴定时边滴边摇动锥形瓶,眼睛应观察___。
④滴定达到终点现象__ 。
(2)滴定结果如下表所示:
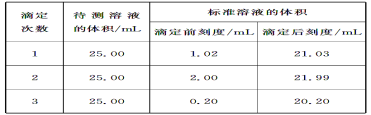
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为___。(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农药波尔多液的主要成分是CuSO4,下列两个反应都有CuSO4生成。
①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②CuO+H2SO4=CuSO4+H2O
反应①的副产物SO2是大气污染物,可用NaOH溶液吸收,发生反应的化学方程式为( )
A.NaOH+SO2=Na2SO3
B.NaOH+SO2=Na2SO3+H2O
C.2NaOH+SO2=Na2SO3+H2O
D.2NaOH+SO2=2NaHSO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物通过浓硫酸时,浓硫酸的质量增加了7.2g;再通过灼热的氧化铜时,氧化铜的质量减少了3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式是( )
A.C2H4B.C2H6OC.C2H6O2D.C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2 =N2+H2O,下列关于该电池工作时的说法正确的是( )
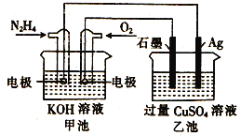
A.该装置工作时,甲池中溶液的pH增大
B.乙池中负极反应为2Ag-2e-+SO42-=Ag2SO4
C.甲池正极反应O2+4e-+4H+=2H2O
D.当甲池中消耗0.05molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某兴趣小组对含有泥沙的粗盐进行提纯实验的流程图,请回答下列问题。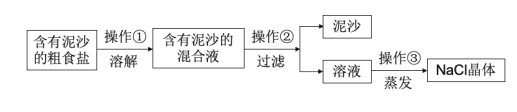
(1)操作②中用到的玻璃仪器是__。
(2)写出操作③中玻璃棒的作用__。
(3)若实验所得NaCl的产率偏低,则可能的原因__(填选项)。
A.过滤时滤纸有破损
B.蒸发时没有用玻璃棒搅拌
C.溶解含泥沙的粗盐时,加入水量不足
D.所得氯化钠晶体没有烘干,带有水分
E.过滤后的滤纸是湿的,纸上的水溶解了一些氯化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com