
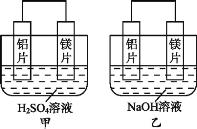
【题目】Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式:____。
(2)乙中负极为__,总反应的离子方程式:___。
(3)由此实验得出的下列结论中,正确的有____。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
Ⅱ.化学电池在通信、交通及日常生活中有着广泛的应用。目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
①放电时Cd作正极 ②放电时Ni元素被还原
③充电时化学能转变为电能 ④放电时化学能转变为电能
Ⅲ.氢气和氧气可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式(当电解质溶液为NaOH(aq)或KOH(aq)时)两种。试回答下列问题:
(1)酸式电池的电极反应:正极_____;
(2)碱式电池的电极反应:负极_______。
【答案】2H++2e-H2↑ Al 2Al+2OH-+2H2O2AlO2-+3H2↑ AD ②④ O2+4e-+4H+2H2O 2H2-4e-+4OH-4H2O
【解析】
Ⅰ.甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,镁作正极,正极发生还原反应,通过对比甲乙实验可知,电解质溶液的酸碱性可能影响电极反应式,电池的正负极判断除了与金属活动性顺序有关,还与电解质有关,据此分析作答;
Ⅱ.根据总反应式结合原电池与电解池的工作原理作答;
Ⅲ. 正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O,碱性条件下与H2O分子结合生成OH-;负极上,酸性条件下H2失电子变为H+,H+进入电解质溶液;碱性条件下H+不能大量存在,与OH-结合生成水。两种环境下电池总反应均是H2和O2生成水的反应。
Ⅰ.根据原电池原理可知,甲中总反应是镁与稀硫酸反应生成硫酸镁与氢气,镁作负极发生失电子的氧化反应,正极上氢离子得电子发生还原反应,其电极反应式为:2H++2e-=H2↑;
(2)乙中铝与氢氧化钠和水发生氧化还原反应,因此铝作该电池的负极,总的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)
A. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质,如酸性条件下活泼金属做负极,而碱性条件下就不一定,A项正确;
B. 镁的金属性比铝的金属性强,B项错误;
C.该实验说明金属活动性顺序表主要指的是酸性条件下金属的还原性,C项错误;
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析,D项正确;
答案选AD;
Ⅱ.电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,则,
2Ni(OH)2+Cd(OH)2,则,
①放电时,Cd转化为Cd(OH)2,元素化合价升高,发生失电子的氧化反应,作原电池的负极,①项错误;
②放电时,Ni元素从+3价降低到+2价,元素被还原,②项正确;
③充电过程利用的是电解池的工作原理,是将电能转化为化学能,③项错误;
④放电过程利用的是原电池的工作原理,是将化学能转变为电能,④项正确;
综上所述,②④项正确,答案为:②④;
Ⅲ. 根据上述分析可知,
(1)酸式电池正极上O2得电子转化为H2O,其电极反应式为:O2+4e-+4H+=2H2O;
(2)碱式电池负极氢气失电子转化为水,其电极反应式为:2H2-4e-+4OH-=4H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
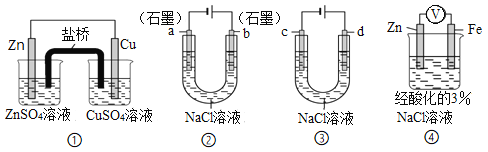
A. 装置①中,盐桥中的Cl-移向CuSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH降低
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,Zn极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a。下列说法正确的是( )
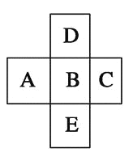
A. B、D的原子序数之差可能为2
B. E、B的原子序数之差可能是8、18或32
C. A、E的原子序数之差可能是7
D. 5种元素的核电荷总数之和可能为5a+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ. 汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
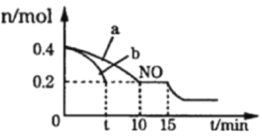
(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=___________;T℃时,该反应的化学平衡常数K=_____________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
(1)若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
(2)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(1)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A.混合气体颜色不再改变 B. 混合气体的密度不再改变
C.混合气体摩尔质量不再改变 D. NH3和NO2的物质的量之比不再改变
(3)将一定比例的O2、NH3和NO2的混合气体,匀速通入图(a)所示装有催化剂M的反应器中充分进行反应。
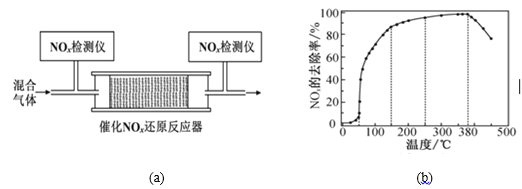
反应相同时间NOx的去除率随反应温度的变化曲线如图(b)所示。已知该催化剂在100~150℃时活性最高,那么在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢,其中去除率迅速上升段的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瓷器(英文名为________)成了中华民族文化的象征之一;作为陶瓷的故乡,我国陶都________的陶器和瓷都________的瓷器,在世界上都享有盛誉.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是
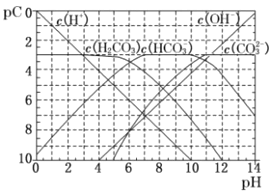
A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
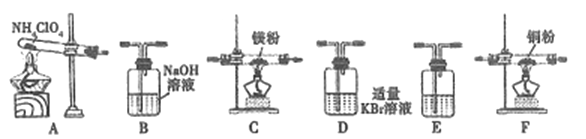
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:
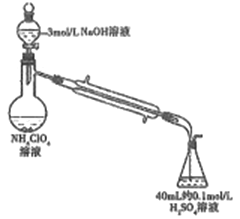
步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com