
将7 mol N2和11 mol H2在适宜条件下按下式进行反应N2+3H2![]() 2NH3,当在某一温度下达到化学平衡状态,试解答:
2NH3,当在某一温度下达到化学平衡状态,试解答:
(1)若测得平衡混合气体对空气的相对密度为0.6时,求N2的转化率.
(2)若测得平衡混合气体对空气的相对密度为0.47时,求N2的转化率.
科目:高中化学 来源:四川省成都外国语学校2011届高三10月月考化学试题 题型:022
在一定温度下
,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中(如图)发生以下的反应: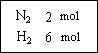
若反应达到平衡后,测得混和气体为7 mol,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1 mol,c=2 mol,则b=________mol,在此情况下,反应起始时将向________方向进行(填“正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是________.
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是________.
查看答案和解析>>
科目:高中化学 来源:山东省临沂高新区实验中学2008-2009学年高三12月月考化学试题 人教版 人教版 题型:022
合成氨工业对化学工业和国防工业具有重要意义.
(1)常温下氨气极易溶于水,其水溶液可以导电.
①用方程式表示氨气溶于水的过程中存在的可逆过程__________________
②氨水中水电离出的c(OH-)________10-7 mol/L(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到依次为________.
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B.A为铵盐,B在标准状况下为气态.在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol A.
①写出氨气和氟气反应的化学方程式________;
②在标准状况下,每生成1 mol B,转移电子的物质的量为________mol.
(3)Ⅰ在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
达到平衡时,体积为反应前的三分之二.求:
①达到平衡时,N2的转化率为________.
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较反应放出的能量:①________②(填“>”、“<”或“=”)
Ⅱ若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.
③试比较平衡时NH3的浓度:Ⅰ________Ⅱ(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源:江西省白鹭洲中学2012届高三上学期期中考试化学试题 题型:022
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应为:N2(g)+3H2(g)![]() 2NH3(g);ΔH<0.
2NH3(g);ΔH<0.
①下列措施可以提高H2的转化率的是(填选项序号)________.
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
②一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g);ΔH>0.
2NO2(g);ΔH>0.
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2,t4时刻只改变一个条件,下列说法正确的是(填选项序号)________.
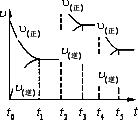
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);ΔH=+67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是________.
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式是________.
查看答案和解析>>
科目:高中化学 来源:山西省太原市五中2009届高三第二学期2月月考化学试题 题型:022
合成氨对工.农业生产和国防都有重要意义.
已知:N2(g)+H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol请回答:
2NH3(g);ΔH=-92.4 kJ/mol请回答:
(1)合成氨对工业中采取的下列措施可以用勒夏特列原理解释的是________(填字母).
a.用铁触媒加快化学反应速率
b.采用较高压强(20M Pa-50M Pa)
c.将原料气中的少量CO等气体净化出来
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应.
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率α1=________,此时反应放出的热量________kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率=α2________α1(填“<”“>”或“=”)
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压.570℃条件下高转化率的电解法合成氨(装置如图).钯电极A是电解池的________极(填“阳”或“阴”),该极上的电极反应式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com