
【题目】2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。

原理如下:(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法不正确的是( )
LiFePO4+nC。下列说法不正确的是( )
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,Li+向左移动
【答案】D
【解析】
放电为原电池原理,从(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC可知,LixCn中的C化合价升高了,所以LixCn失电子,作负极,那么负极反应为:
LiFePO4+nC可知,LixCn中的C化合价升高了,所以LixCn失电子,作负极,那么负极反应为:![]() +nC,LiFePO4作正极,正极反应为:
+nC,LiFePO4作正极,正极反应为:![]() ,充电为电解池工作原理,反应为放电的逆过程,据此分析解答。
,充电为电解池工作原理,反应为放电的逆过程,据此分析解答。
A.由以上分析可知,放电正极上![]() 得到电子,发生还原反应生成
得到电子,发生还原反应生成![]() ,正极电极反应式:
,正极电极反应式:![]() ,A正确;
,A正确;
B.原电池中电子流向是负极![]() 导线
导线![]() 用电器
用电器![]() 导线
导线![]() 正极,放电时,电子由负极经导线、用电器、导线到正极,B正确;
正极,放电时,电子由负极经导线、用电器、导线到正极,B正确;
C.充电时,阴极为放电时的逆过程,![]() 变化为
变化为![]() ,电极反应式:
,电极反应式:![]() ,C正确;
,C正确;
D.充电时,作为电解池,阳离子向阴极移动,![]() 向右移动,D错误;
向右移动,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为___________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3



①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________(填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为______。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为_____mol。
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3____0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是______(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)_____c(NH3·H2O)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
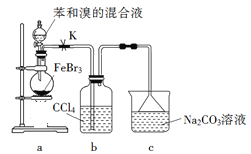
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
(1)写出NO2和SO2反应的热化学方程式为_________.
(2)随温度升高,该反应化学平衡常数变化趋势是_____.
II.(1)目前,应用NH3的催化还原法来进行烟气氮氧化物脱除,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0,该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
(2)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
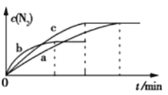
①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______,判断的依据是___________________。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(3)用NH3和Cl2反应可以制备具有强氧化性的三氯胺(三氯胺在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质),方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②该反应的ΔH__________0(填“>”或“<”)。
③该反应自发进行的条件是__________(填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化为放热反应的是( )
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁元素位于元素周期表中第______周期,第______族;
(2)Fe3+的电子排布式______
(3)Fe2+的外围电子轨道表示式______
(4)为什么Fe3+在自然界Fe的各种存在形式中最为常见?______
(5)目前发现的铁的最高化合价是+6价,理论上最高价是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示![]() 省略夹持和净化装置
省略夹持和净化装置![]() 仅用此装置和表中提供的物质完成相关实验,最合理的选项是
仅用此装置和表中提供的物质完成相关实验,最合理的选项是
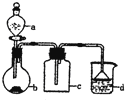
选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 |
A | 浓氨水 | NaOH |
|
|
B | 浓盐酸 |
|
| NaOH溶液 |
C | 稀硝酸 | Cu | NO |
|
D | 浓硫酸 |
|
| NaOH溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2浓度变化表示的化学反应速率v(Y2)=0.1 mol·(L·min)-1,生成的c(Z)为0.4 mol·L-1,则该反应的反应式可以表示为( )
A. X2+2Y2![]() 2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2![]() 2X2Y
2X2Y
C. 3X2+Y2![]() 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的快慢和限度对人类生产生活有重要的影响。800℃时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,回答下列问题:
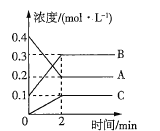
(1)该反应的生成物是________。
(2)2min内,C的反应速率为________。
(3)该反应的化学方程式为________。
(4)在其他条件下,测得A的反应速率为![]() ,此时的反应速率与800℃时相比_____。
,此时的反应速率与800℃时相比_____。
A.比800℃时慢 B.比800℃时快 C.和800℃时速率一样
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com