
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO![]() +NO
+NO![]() +_____=Mn2++NO
+_____=Mn2++NO![]() +H2O。
+H2O。
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
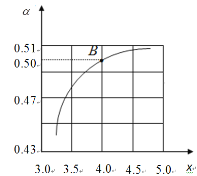
其它条件不变时,α随着x/span>增大而增大的原因是____;图中的B点处NH3的平衡转化率为____。
II.(4)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为________。
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=___(用n表示)。
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成__沉淀(填化学式);当测得溶液中钙离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c = ______mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)
【答案】吸热 K值小,正向进行的程度小(或转化率低),不适合大规模生产; 2MnO![]() +5NO
+5NO![]() +6H+=2Mn2++5NO
+6H+=2Mn2++5NO![]() +3H2O x增大,相当于c(NH3)增大,CO2转化率增大 25% PCl5(g)
+3H2O x增大,相当于c(NH3)增大,CO2转化率增大 25% PCl5(g) ![]() PCl3(g) + Cl2(g) △H = +93 kJ·mol-1 3n+1 Mg3(PO4)2 10-6
PCl3(g) + Cl2(g) △H = +93 kJ·mol-1 3n+1 Mg3(PO4)2 10-6
【解析】
Ⅰ(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮;
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
(2)NaNO2可用酸性KMnO4溶液检验,根据氧化还原反应相关配平原则,遵守质量守恒定律、电荷守恒定律,可以推出反应方程式为:2MnO![]() +5NO
+5NO![]() +6H+=2Mn2++5NO
+6H+=2Mn2++5NO![]() +3H2O;
+3H2O;
(3)工业以NH3和CO2为原料合成尿素[CO(NH2)2]:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0,CO2平衡转化率(α)随(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0,CO2平衡转化率(α)随(氨碳比)![]() = x的变化如图所示,氨碳比(x)越大,相当于增大
= x的变化如图所示,氨碳比(x)越大,相当于增大![]() ,故平衡正向移动,CO2平衡转化率(α)随之增大;B点对应
,故平衡正向移动,CO2平衡转化率(α)随之增大;B点对应![]() =4,且反应后CO2转化率为50%,物质的转化量之比与化学计量数呈比例关系,假设投料:
=4,且反应后CO2转化率为50%,物质的转化量之比与化学计量数呈比例关系,假设投料:![]() =4X,则
=4X,则![]() =x,又二氧化碳转化0.5x,氨气转化的是二氧化碳的2倍,故氨气转化x,氨气的转化率为:
=x,又二氧化碳转化0.5x,氨气转化的是二氧化碳的2倍,故氨气转化x,氨气的转化率为:![]() ;
;
故答案为:x增大,相当于c(NH3)增大,CO2转化率增大;25%;
II(4)根据盖斯定律及热化学方程式的书写原则,第一个反应减去第二个反应可得出气态PCl5生成气态PCl3和Cl2的热化学方程式为:2PCl5(g) ![]() 2PCl3(g)+2 Cl2(g) △H = +186 kJ·mol-1;简化后为:PCl5(g) PCl3(g) + Cl(g) △H = +93 kJ·mol-1;
2PCl3(g)+2 Cl2(g) △H = +186 kJ·mol-1;简化后为:PCl5(g) PCl3(g) + Cl(g) △H = +93 kJ·mol-1;
(5)已知直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,根据化学式的书写原则,化学式的总化合价为0,铵根的化合价为+1,又氧元素为-2价,PnOx的总化合价为-(n+2)价,可以列式:![]() ,可得x=3n+1;
,可得x=3n+1;
(6)Ca3(PO4)2与Mg3(PO4)2是同类型沉淀,已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26,故一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,溶度积常数小的先生成沉淀,先生成Mg3(PO4)2沉淀;当测得溶液中钙离子沉淀完全,则钙离子浓度为10-5mol·L-1,根据Ca3(PO4)2沉淀溶解平衡可知: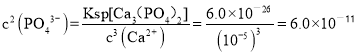 ,则在Mg3(PO4)2沉淀溶解平衡中:
,则在Mg3(PO4)2沉淀溶解平衡中: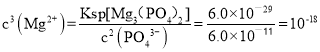 ,则
,则![]() 。
。


科目:高中化学 来源: 题型:
【题目】铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
(1)①某原电池装置如图所示,右侧烧杯中的电极反应式为__,左侧烧杯中的c(Cl-)__(填“增大”、“减小”或“不变”)。
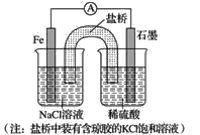
②已知如图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料_____(填“Fe”或“C”)。
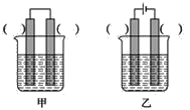
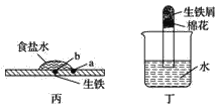
(2)装置丙中,易生锈的是__(填“a”或“b”)点。装置丁中可观察到的实验现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据《化学反应原理》中相关知识,按要求作答。
氯的单质、化合物与人类生产、生活和科研密切相关。
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+Cl2(g)=2HCl(g)△H = -184.6 kJ . mol-1,判断该反应属于_____(填“吸热”或“放热")反应。
(2)盐酸是一种强酸,补充完整电离方程式:HCl=___+Cl- 。室温下,将大小相等的镁条和铁片投入同浓度的稀盐酸中,产生氢气的速率较大的是________。
(3)84消毒液在防控新冠肺炎疫情中被大量使用,它是利用氯气与氢氧化钠溶液反应制成的.反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
①该反应____(填“是”或“不是”)氧化还原反应。
②室温下,84消毒液呈碱性,其pH___7 (填“>”或“<”)。
③84消毒液的有效成分NaClO,水解的离子方程式:ClO-+H2O=HClO+OH-,生成物中__具有很强的氧化性,可以使病毒和细菌失去生理活性;水解是吸热反应,升高温度平衡向_____(填“正反应”或“逆反应”)方向移动。
(4)电解熔融氯化钠可制取金属钠和氯气,装置如图所示(电极不参与反应):
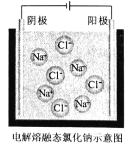
通电时,Na+向______(填“阳极”或“阴极")移动,写出生成金属钠的电极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50mol/LNaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、______、_______以及等质量的两片纸片。
(2)计算。配制该溶液需取NaCl晶体_______g。
(3)配置过程。
①天平调零。
②称量过程中NaCl晶体应放于天平的_______(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
④溶解、冷却,该步实验中需要使用玻璃棒,目的是________。
⑤转移、洗涤。在转移时应使用_____引流,需要洗涤烧杯2-3次是为了______。
⑥定容、摇匀。
⑦将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
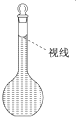
(4)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置制取溴苯和溴乙烷.已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-190℃,密度为1.46gcm-3。
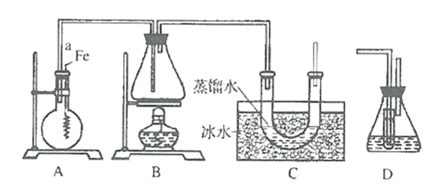
主要实验步骤如下:
①检查装置的气密性后,向圆底烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至浸没进气导管口。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min。
请填写下列空白:
(1)写出A装置中制取溴苯的化学方程式__。
(2)导管a的作用是__。
(3)C装置中U型管内部用蒸馏水封住管底的作用是__。
(4)反应完毕后,U型管内液体分层,溴乙烷在__层(填:上或下)。
(5)步骤④中__(填“能”“否”)用大火加热,理由是__。
(6)为探究溴和苯的上述反应是取代反应而不是加成反应,用装置D代替装置B、C直接与A相连重新操作实验。
①装置D中小试管内装有CCl4,其主要作用是__。
②锥形瓶中装有水,反应后向锥形瓶的水溶液中滴加硝酸银溶液,若有__产生,证明该反应为取代反应。
(7)要检验某溴乙烷中的溴元素,正确的实验方法是:向盛有适量溴乙烷的试管中__。
A.加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色
B.滴入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察是否有浅黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
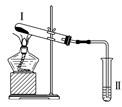
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质氧化镁和硼酸(H3BO3)都是重要的化工原料,可采用硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如图:
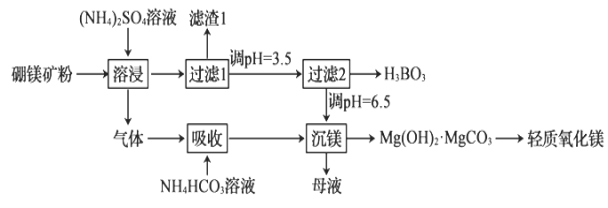
下列叙述错误的是( )
A.Fe2O3、Al2O3都不能溶于(NH4)2SO4溶液
B.进入“吸收”工序中的气体为NH3
C.若“过滤2”时调节溶液的碱性越强得到的硼酸越多
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断下列有关说法正确的是( )
A.羰基硫属于非极性分子B.羰基硫的电子式为![]()
C.羰基硫的沸点比CO2低D.羰基硫分子中三个原子处于同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图进行实验,探究H2O2的分解反应。
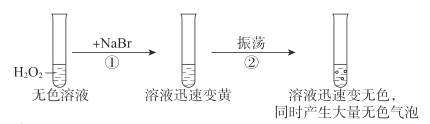
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com