
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:

(1)金属钛晶胞如图1所示,为___________堆积(填堆积方式)。
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是________________。
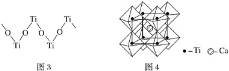
(3)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为_______________。
(4)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被__________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围,钙钛矿晶体的化学式为____________。
【答案】六方最密 化合物乙含有N—H键,化合物乙分子间形成氢键 ![]() (或
(或![]() ) 6 12 CaTiO3
) 6 12 CaTiO3
【解析】
(1)Ti原子核电荷数为22,价电子排布式为3d24s2,金属钛晶胞结构为二层相互错开,第三层正对第一层的方式堆积而成的;
(2)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键,故分子间作用力比化合物甲强;
(3)该图中每个Ti原子连接O原子个数=2×![]() =1,即Ti、O原子个数之比为1:1,由此确定其化学式;
=1,即Ti、O原子个数之比为1:1,由此确定其化学式;
(4)钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子,包围着中心的钙离子,可以根据晶胞的均摊原则确定晶胞的化学式。
(1)钛原子的价电子排布式为3d24s2,根据其晶胞结构可知,晶体钛为六方最密堆积形;
(2)化合物乙分子中有-NH2,因此其分子间存在氢键,而化合物甲分子之间只存在分子间作用力,因此化合物乙的沸点比化合物甲高;
(3)该图中每个Ti原子连接O原子个数=2×![]() =1,即Ti、O原子个数之比为1:1,其化学式为(TiO)n2n+(或TiO2+);
=1,即Ti、O原子个数之比为1:1,其化学式为(TiO)n2n+(或TiO2+);
(4)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×![]() =3,则晶胞的化学式为CaTiO3。
=3,则晶胞的化学式为CaTiO3。


科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示:

且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是
A.YW3分子中的键角为120°
B.W2Z的稳定性大于YW3
C.物质甲分子中存在6个σ键
D.Y元素的氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向2 L恒容密闭容器中充入1 mol A,发生2A(g)![]() B(g)+C(g)反应。反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
B(g)+C(g)反应。反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
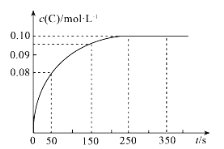
A.反应在0~50 s的平均速率v(C)=1.6×10-3molL-1s-1
B.该温度下,反应的平衡常数K=0.025 molL-1
C.保持其他条件不变,升高温度,平衡时c(B)=0.09 molL-1,则该反应的H<0
D.反应达平衡后,再向容器中充入1 mol A,该温度下再达到平衡时,A的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的最外层电子排布为![]() ,下列对其核外电子运动的说法错误的是( )
,下列对其核外电子运动的说法错误的是( )
A. 有5种不同的运动范围B. 有5种不同能量的电子
C. 有4种不同的伸展方向D. 有14种不同运动状态的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表_____族。Cu2+的外围电子排布式为_____________。
(2)Cu元素可形成![]() ,其中存在的化学键类型有_____________(填序号)。
,其中存在的化学键类型有_____________(填序号)。
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(3)若![]() 具有对称的空间构型,且当其中的两个NH3被两个Cl取代时,能到两种不同结构的产物,则
具有对称的空间构型,且当其中的两个NH3被两个Cl取代时,能到两种不同结构的产物,则![]() 的空间构型为____________(填字母)。
的空间构型为____________(填字母)。
a.平面正方形 b.正四面体 c.三角锥型 d.V形
(4)在硫酸铜溶液中逐滴滴加氨水至过量,实验现象为先出现蓝色沉淀,最后沉淀溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:______________。
(5)Cu2O的熔点比Cu2S的__________(填“高”或“低”),请解释原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )
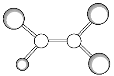
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有![]()
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙烯和氯化氢加成反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A.分子中3个碳原子在同一直线上
B.分子中所有原子都在同一平面上
C.分子中共价键的夹角均为120°
D.分子中共价键数为8,其中有一个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+等)为原料制备氧化锌的流程如下:
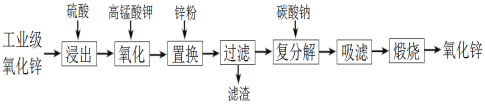
其中“氧化”加入KMnO4是为了除去浸出液中的Fe2+和Mn2+。下列有关说法错误的是
A. 浸出时通过粉碎氧化锌提高了浸出率
B. “氧化”生成的固体是MnO2和Fe(OH)3
C. “置换”加入锌粉是为了除去溶液中的Cu2+、Ni2+等
D. “煅烧”操作用到的仪器:玻璃棒、蒸发皿、泥三角
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com