
实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
(1)实验装置:
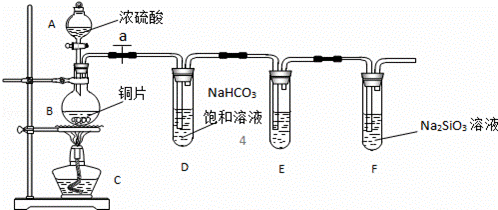
填写所示仪器名称A B
(2)实验步骤:
连接仪器、 、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液(具有强氧化性)的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”),试管D中发生反应的离子方程式是 .
考点:
非金属在元素周期表中的位置及其性质递变的规律;比较弱酸的相对强弱的实验.
专题:
实验探究和数据处理题.
分析:
(1)根据装置图中的仪器分析;
(2)反应生成气体,在加入药品之前需要检验装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,据此写出反应方程式;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强;
③依据最高价含氧酸的酸性强弱判断非金属性强弱.
解答:
解:(1)根据装置图中的仪器可知A为分液漏斗,B为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验,
CuSO4+SO2↑+2H2O;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验,
故答案为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;除去SO2气体;
CuSO4+SO2↑+2H2O;除去SO2气体;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:盛有Na2SiO3溶液的试管中出现白色沉淀;
③依据最高价含氧酸的酸性强弱判断非金属性强弱,二氧化硫溶于水生成的是亚硫酸,不是最高价含氧酸,所以不能判断非金属性强弱,试管D中发生反应是二氧化硫与碳酸氢钠生成二氧化碳,其离子方程式为:SO2+2HCO3﹣=SO32﹣+H2O+2CO2,
故答案为:否;SO2+2HCO3﹣=SO32﹣+H2O+2CO2.
点评:
本题考查了非金属性的相对强弱的探究实验,涉及仪器名称,化学方程式的书写,离子方程式的书写,判断非金属性强弱的依据等 考查的知识点较多,难度中等.


科目:高中化学 来源: 题型:
、TiO2可通过下述两种方法制备金属钛:
方法一:电解TiO2来获得Ti,将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用石墨作电解槽池.
(1)阳极的电极反应式为 .
(2)电解过程中需定期更换石墨电极的原因是 .
方法二:先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(3)TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1该反应难以发生,原因是 .
不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4,当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1
TiO2(s)+C(s)+2Cl2(g)=TiCl4(l)+CO2(g)△H=
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;②向上述稀硫酸中插入铜片,没有看到有气泡生成;③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转.下列关于以上实验设计及现象的分析,不正确的是( )
|
| A. | 实验①、②说明锌能与稀硫酸反应而铜不能 |
|
| B. | 实验③说明发生原电池反应时会加快化学反应速率 |
|
| C. | 实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
|
| D. | 实验④说明该原电池中铜为正极、锌为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应N2(g)+3H2(g)⇌2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol•L﹣1、0.3mol•L﹣1、0.08mol•L﹣1,则下列判断正确的是( )
|
| A. | C1:C2=1:3 |
|
| B. | 平衡时,H2和NH3的生成速率之比为2:3 |
|
| C. | N2、H2的转化率之比为1:3 |
|
| D. | C1的取值范围为0.04mol•L﹣1<Cl<0.14mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 卤代烃在NaOH存在下水解生成的有机物都是醇 |
|
| B. | 所有的一元醇都能被氧化为具有相同碳原子数的醛或酮 |
|
| C. |
|
|
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验处理不可行的是( )
①将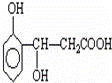 与NaOH的醇溶液共热制备CH3﹣CH═CH2
与NaOH的醇溶液共热制备CH3﹣CH═CH2
②向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热﹣﹣检验混合物中是否含有甲醛
③向丙烯醛(CH2=CH﹣CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入几滴硝酸银溶液,观察现象.
|
| A. | 只有①③ | B. | 只有①②④ | C. | 只有②③④ | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
泡沫灭火机内装的药液之一是NaHCO3饱和溶液,而不选用更廉价的Na2CO3饱和溶液,其原因是( )
①质量相同的两种钠盐,NaHCO3与足量酸反应产生的CO2比Na2CO3多
②产生相同体积 (同温,同压)的CO2,消耗酸的量NaHCO3比Na2CO3少
(同温,同压)的CO2,消耗酸的量NaHCO3比Na2CO3少
③NaHCO3与酸反应比Na2CO3快得多
④NaHCO3比Na2CO3稳定,便于长期保存.
A.只有①③
B.只有②③
C.①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol H2SO4 B.气体甲中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn D.反应中共转移3 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com