
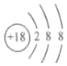

| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①最简式即物质中各原子的最简单的整数比.写出各物质的分子式,进而写出最简式,
②二氧化硅是原子构成的化合物,
③HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O;
④乙烯分子中含碳碳双键,需要写出;
⑤氯离子是由氯原子的得到一个电子后形成的,核内质子数为17,核外电子数18;
⑥过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物;
⑦H2CO3的电离分步电离;
⑧吸氧腐蚀是中性电解质溶液中发生的原电池反应;
解答 解:①乙酸分子式C2H4O2,乙酸的最简式:CH2O,故①正确;
②SiO2是原子构成,不是分子式是化学式,故②错误;
③次氯酸分子中O原子分别与H、Cl原子之间之间形成1对共用电子对,故HClO的结构式为H-O-Cl,故③错误;
④乙烯是结构简式:CH2=CH2 ,故④错误;
⑤氯离子是由氯原子的得到一个电子后形成的,核内质子数为17,核外电子数18,离子的结构示意图是: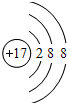 ,故⑤错误;
,故⑤错误;
⑥过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,是由Na+与O22-构成的,故⑥错误;
,是由Na+与O22-构成的,故⑥错误;
⑦H2CO3的电离方程式为:H2CO3?H++HCO3-,HCO3-=H++CO32-,故⑦正确;
⑧吸氧腐蚀是中性电解质溶液中发生的原电池反应,正极电极反应O2+4e-+2H2O═4OH-,故⑧错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、原子结构示意图、分子式和结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 古文 | 解释 |
| A | 烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露 | 白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯 |
| B | 白青(碱式碳酸铜)得铁化为铜 | 可以用铁来冶炼铜 |
| C | 初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之 | 蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 |
| D | 丹砂烧之成水银,积变又成丹砂 | 加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和铜在自然界中主要以游离态的形式存在 | |
| B. | 工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 | |
| C. | 常温下铁与浓硫酸不反应 | |
| D. | 用激光照射硫酸铜溶液可观察到丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
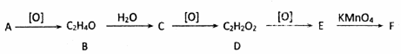
 ,其产量可以用来衡量一个国家石油化工的发展水平.
,其产量可以用来衡量一个国家石油化工的发展水平. ,且无环状结构的同分异构体有8种.(不考虑立体异构)
,且无环状结构的同分异构体有8种.(不考虑立体异构) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeBr2溶液中加入少量氯水,再加 CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
| B | 向盐酸中滴入少量NaAlO2溶液 | 无明显现象 | AlO2-与H+未发生反应 |
| C | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸罝于试管口 | 试纸颜色无 明显变化 | 原溶液中无NH4+ |
| D | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH | 前者的pH 比后者的大 | 元素非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
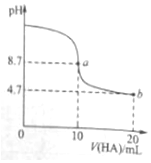 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(A-)+c(HA)=0.1mol•L-1 | |
| B. | b点所示溶液中c(HA)>c(A-) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | a、b两点所示溶液中水的电离程度a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Si3N4>NaCl>Sil4 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| D. | 常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液中:K+、Na+、HCO3-、Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com