
下列关于有机化合物的说法错误的是
A.2,2-甲基丙烷也称新戊烷
B.由乙烯生成乙醇属于加成反应
C.分子式为C5H11Cl的有机物共有8种(不含立体异构)
D.所有的糖类、油脂、蛋白质都可以发生水解反应
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
下列性质中,可以证明某化合物内一定存在离子键的是
A.可溶于水 B.熔融状态能导电
C.水溶液能导电 D.具有较高的熔点
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
关于反应:HgS+O2=Hg+SO2,下列叙述不正确的是
A.O2在反应中作氧化剂 B.该反应转移了4e-
C.Hg是被还原得到的产物 D.HgS既是还原剂又是氧化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
下列物质的俗称表示同一物质的是
A.明矾、胆矾 B.冰、干冰 C.火碱、烧碱 D.苏打、小苏打
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:填空题
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77 kJ•mol-1
CH3OH(g) △H3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2= (用K1、K3表示)。
(2)反应Ⅲ自发进行条件是 (填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T 500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= 。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:填空题
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH= 。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g) 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H_0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为____________;
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:选择题
靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X。己知X的结构如下,下列有关X的说法正确的是
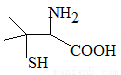
A.X为烃的含氧衍生物
B.X的分子式为C5H10NO2S
C.X只能发生取代反应
D.X中碳原子上的H若有1个被Cl取代,有2种不同产物
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:选择题
某溶液中有NH4+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入 过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是
过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是
A.NH4+、Mg2+ B.Mg2+、Fe2+ C.NH4+、Fe2+ D.Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康。海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)天然水净化处理过程中需要加入混凝剂,常用的混凝剂有明矾、硫酸铝、硫酸铁等,写出明矾净水作用的原理是(用离子方程式及相关语言描述)___________________。
(2)目前,国际上使用的“海水淡化”主要技术之一是电渗析法,如图是利用电渗析法对海水进行淡化处理的原理图。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为惰性电极。
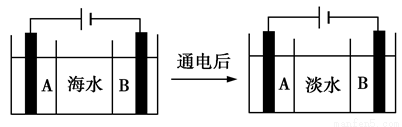
①阳离子交换膜(只允许阳离子通过)是________(填“A”或“B”);
②写出通电后阳极区的电极反应式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com