


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都市玉林中学高一下学期期中考试化学试卷(带解析) 题型:实验题
(7分)将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是 。
(2)写出有关反应的化学方程式 。
(3)实验中观察到的现象有 、 和反应混合物成糊状。
(4)通过 现象,说明该反应为 (填“吸热”或“放热”)反应,这是由于反应物的总能量 (填“小于”或“大于”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻片上。用玻璃棒迅速搅拌,一会儿可发现水结冰并将玻片粘在烧杯上。
①实验中玻璃棒的作用是 。
②写出有关反应的化学方程式 。
③通过 现象,说明该反应为 (填“吸热”或“放热”)反应;这是由于反应物的总能量 (填“小于”或“大于”)生成物的总能量。
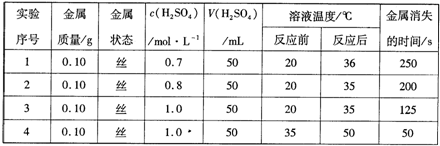
(2)下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:ww w.ks5 u.co m
①该金属与稀硫酸进行的反应属于
A. 放热反应 B. 复分解反应 C. 氧化还原反应 D. 离子反应 E. 置换反应
②实验1、2可得出的结论是 ;实验3、4可得出的结论是 。
③如果将实验用的金属丝先浸入硫酸铜溶液一段时间后,再取出进行上述实验4,则反应需要的时间应 (填“>”或“<”)50s,你认为比较合理的解释是: 。
④若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡。该金属的金属活动性比铁 (选填“强”或“弱”),铁在该原电池中作 极。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,用玻璃棒迅速搅拌,用手触摸烧杯外壁。
①实验中玻璃棒的作用是 。
②写出有关反应的化学方程式 。
③通过手的触感,说明该反应为 (填“吸热”或“放热”)反应,这是由于反应物的总能量 (填“小于”或“大于”)生成物的总能量。
(2)已知键能: N≡N 946KJ/mol, H-H 436KJ/mol, H-N 391KJ/mol。
写出合成氨反应的热化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com