

 .
.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
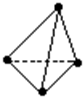 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷(P4)相同,如图所示,已知断裂1molN-N键吸收167KJ能量,生成1molN≡N放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷(P4)相同,如图所示,已知断裂1molN-N键吸收167KJ能量,生成1molN≡N放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )| A、N4分子是一种新型化合物 |
| B、N4和N2互为同素异形体 |
| C、N4分子的沸点比白磷分子的高 |
| D、1molN4转变为N2将吸收882KJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢的摩尔质量为l g/mol |
| B、1个氮分子的摩尔质量为28 g |
| C、水的摩尔质量为18 g |
| D、NO3-的摩尔质量为62 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13C与C60互为同素异形体 |
| B、15N与14N互为同位素 |
| C、13C与15N有相同的中子数 |
| D、15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、学生甲认为苯酚不慎沾在皮肤上时,根据苯酚能够与65℃以上的水任意比混溶,所以最好马上用65℃以上的水进行洗涤 |
| B、学生乙在做酸碱中和滴定实验时,将标准液盐酸溶液通过移液管移入锥形瓶,并滴加1-2滴酚酞作为指示剂,而待测液氢氧化钠溶液装入碱式滴定管进行滴定 |
| C、学生丙在称量某固体样品的质量时,托盘一端放入5克砝码,并将游码用镊子沿着刻度尺向盛样品的一端移动后,停在1.2克和1.3克偏右的某一处时,天平平衡,该生马上得到该样品的质量为6.3克 |
| D、学生丁在做中和热测定时,认为应用稀的含等物质的量的H+和OH-的溶液反应来进行测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,满足上述条件的除A外还有
,满足上述条件的除A外还有查看答案和解析>>
科目:高中化学 来源: 题型:

 耗NaOH溶液的体积,分别计算乙酰水杨酸的质量分数.在上述测定过程中,为防止乙酰水杨酸在滴定过程中水解,应如何正确操作?并说明理由.
耗NaOH溶液的体积,分别计算乙酰水杨酸的质量分数.在上述测定过程中,为防止乙酰水杨酸在滴定过程中水解,应如何正确操作?并说明理由.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a) g CuCO3 |
| B、?b<a<7 |
| C、阳极电极反应:2H2O-4e-═O2↑+4H+ |
| D、整个过程中是阳极产生氧气,阴极析出铜单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com