
 �״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã�
�״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã� CH3OH��g����H1
CH3OH��g����H1 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
| 0.8 |
| 1 |
| c(CH3OH) |
| c(CO)��c2(H2) |
| 0.4mol/L |
| 0.1mol/L��(0.2mol/L)2 |
| 1 |
| 2 |
| 1 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014������ʡ�����и�����ѧ�ڵ�һ�������в��Ի�ѧ�Ծ��������棩 ���ͣ������
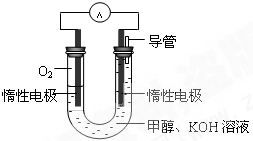
�״�����Ҫ�Ļ���ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2�������״����״���
���������Ϣ���±���
��1����Ӧ����____��Ӧ��ѡ����ȡ������ȡ�����
��2�����ϱ���Ϣ�Ƶ���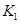 ��
��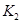 ��
��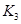 ֮��Ĺ�ϵ��
֮��Ĺ�ϵ��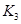 =______��
=______��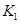 ��
��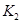 ��ʾ����500��ʱ��÷�Ӧ����ijʱ�̣�
��ʾ����500��ʱ��÷�Ӧ����ijʱ�̣�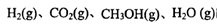 ��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ
��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ ��ѡ�>����<����=������
��ѡ�>����<����=������
��3)��ij�¶��·�Ӧ�ٴӿ�ʼ��ƽ��CO��CH3OH��Ũ�ȱ仯��ͼһ��ʾ������H2Ũ�ȱ仯��ʾ�˶�ʱ���ڸ÷�Ӧ��ƽ����.v(H2)=
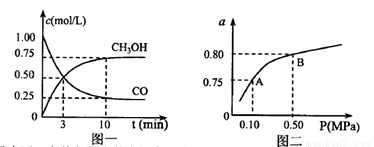
��ij�¶��·�Ӧ����H2��ƽ��ת����(a)����ϵ��ѹǿ(P)�Ĺ�ϵ��ͼ����ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ�� ��ѡ�>����<����=������
��ѡ�>����<����=������
��4��һ���¶��£�������̶����ܱ������з�����Ӧ�ڣ����жϸ÷�Ӧ�Ѿ��ﵽƽ�����____��������Ӧ��ĸ��ʾ��
A����������ѹǿ����
B����̨�����ƽ��Ħ������Ҳʼ�ձ��ֲ��䣬
C�����������ܶȲ���
D��CO2(g)��CO(g)��Ũ�Ȳ���
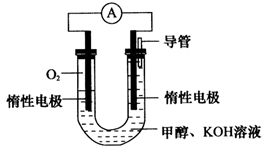
��5��һ�������¼״���һ����̼��Ӧ�ɺϳɴ��ᡣ�����£���a mol/L������Һ��bmol/LNaOH��Һ�������ϡ�����Һ�����ԣ���a_________b��ѡ�>����<����=��������c(Na��)<c(CH3COO��)������Һ��____�ԣ�ѡ��ᡱ����С�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ�����и����ڶ�������������ۻ�ѧ�Ծ��������棩 ���ͣ������
�״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�á�
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g����2H2��g��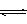 CH3OH��g��
CH3OH��g��
��Ӧ��CO2��g����3H2��g��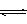 CH3OH��g����H2O��g��
CH3OH��g����H2O��g��
���������Ʊ��״���������Ӧ�У���Ӧ�����ڷ�Ӧ��ԭ��Ϊ_________________��
�ڶ��ڷ�Ӧ����ͼ�ױ�ʾ�����ı仯��ͼ�ұ�ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ���ͻ���
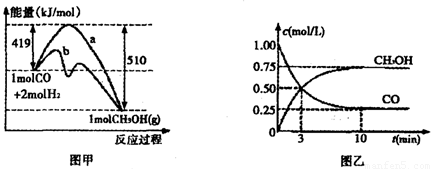
�ڡ�ͼ�ס��У�����__________�����a����b������ʾʹ���˴������÷�Ӧ����________��������ȡ��������ȡ�����Ӧ����ͼ���дӷ�Ӧ��ʼ������ƽ�⣬��H2Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ_____________�����¶���CO��g����2H2��g�� CH3OH��g���Ļ�ѧƽ�ⳣ��Ϊ__________.
CH3OH��g���Ļ�ѧƽ�ⳣ��Ϊ__________.
�۶��ڷ�Ӧ����һ���¶�ʱ����lmol CO2���3mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊa���������ڵ�ƽ��ѹǿ����ʼѹǿ֮��Ϊ__________���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���____________��
a�������¶�
b������CO2����
c������He��ʹ��ϵ��ѹǿ����
d����ԭ�����ٳ���CO2��H2
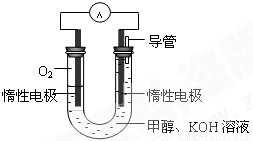
��2���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ������������ ��Ⱦ����ԭ���ǣ�ͨ���Co2��������Co3����Ȼ����Co3������������ˮ�еļ״�������CO2��������ʵ��������ͼװ��ģ���������̡�
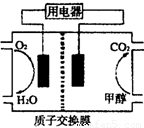
�������缫��ӦʽΪ____________��
�ڳ�ȥ�״������ӷ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������������ģ���� ���ͣ������
 CH3OH(g) ��H1
CH3OH(g) ��H1  CH3OH(g)+H2O(g) ��H2
CH3OH(g)+H2O(g) ��H2 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011����������һ�и߿���ѧ��ģ�Ծ��������棩 ���ͣ������
 CH3OH��g����H1
CH3OH��g����H1 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com