
【题目】化学反应前后肯定没有变化的是
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
A.①④B.①③⑤C.①③④D.①②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ |
阴离子 | NO3- CO32- SiO32- SO42- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是________。
(2)实验Ⅰ中生成沉淀的离子方程式为________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 | ____ | ____ | ____ | ____ |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂除去各组物质中的杂质,可选试剂不正确的是
A. 乙醇中的水(新制CaO) B. 乙烷中乙烯(溴水)
C. 苯中的甲苯(溴水) D. 粗硝基苯溶有的NO2(NaOH溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4g铜与100g98%H2SO4在烧瓶中加热发生反应.
(1)铜完全溶解后,计算生成的气体在标准状况下的体积是多少?
(2)将反应后烧瓶中的物质配成500mL溶液. ①在配制过程中用到的仪器有;配制溶液时,若稀释后立即转移并定容,则所配得的溶液浓度(填“偏大”“偏小”或“不变”).
②求所配得溶液中H2SO4的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米CdSe(硒化镉)可用作光学材料。在一定条件下,由Na2SO3和Se(硒,与S为同族元素)反应生成Na2SeSO3(硒代硫酸钠);再由CdCl2形成的配合物与Na2SeSO3反应制得CdSe纳米颗粒。流程图如下:

注:①CdCl2能与配位剂L形成配合物[Cd(L)n]Cl2
[Cd(L)n]Cl2=[Cd(L)n]2++2Cl-;[Cd(L)n]2+Cd2++nL
②纳米颗粒通常指平均粒径为1~100nm的粒子。
请回答:
(1)图1加热回流装置中,仪器a的名称是________,进水口为________(填1或2)

(2)①分离CdSe纳米颗粒不宜采用抽滤的方法,理由是___________________________。
②有关抽滤,下列说法正确的是______________。
A.滤纸应比漏斗内径略小,且能盖住所有小孔
B.图2抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
(3)研究表明,CdSe的生成分两步:①SeSO32-在碱性条件下生成HSe-;②HSe-与Cd2+反应生成CdSe。
完成第①步反应的离子方程式 SeSO32-+_________=HSe-+__________。
写出第②步反应的离子方程式_________________________________________。
(4)CdSe纳米颗粒的大小影响其发光性质。某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图3所示;同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图4所示。
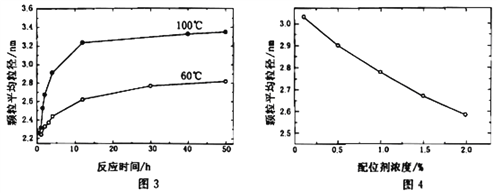
下列说法正确的是__________。
A.改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒
B.在图3所示的两种温度下,只有60℃反应条件下可得到2.7 nm的CdSe纳米颗粒
C.在其它条件不变时,若要得到较大的CdSe纳米颗粒,可采用降低温度的方法
D.若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算:
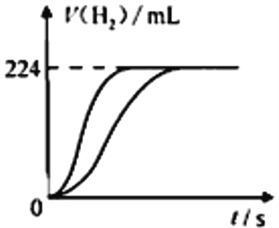
(1)稀释后H2SO4溶液的物质的量浓度为________mol·L-1。
(2)加入Fe的质量至少有____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸或硫酸和NaOH溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明NaOH溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题:
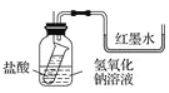
(1)方案一:如图装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内NaOH溶液混合,此时观察到的现象是________________________________,原因是______________________________
(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果NaOH溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的NaOH溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
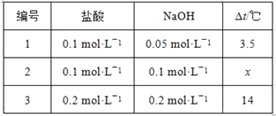
则x=______
(3)若HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;现有:①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq) ③稀HNO3与Ba(OH)2(aq)反应生成1 mol H2O(l)的反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3三者由小到大的关系为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.灼热的碳与CO2的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.铝片与稀盐酸的反应
D.甲烷在氧气中的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com