
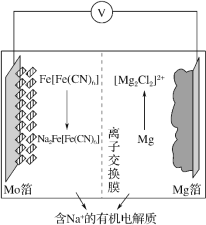
【题目】在 2019 年第十届国际二次电池展中,一种以 Fe[Fe(CN)6]为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是
A.充电时,阴极反应式为 Fe[Fe(CN)6 ]+2Na++2e- =Na2Fe[Fe(CN)6 ]
B.充电时,Mg 箔接电源的正极
C.放电时,Na+通过离子交换膜从右室移向左室
D.放电时,外电路中通过 0.4mol 电子时,负极质量变化为 9.2g
【答案】C
【解析】
放电过程中Mg转化为[Mg2Cl2]2+,发生氧化反应,所以Mg箔为电池的负极,则Mo箔为电池的正极。
A.放电时,Mg箔为负极发生氧化反应,则充电时Mg箔上得电子发生还原反应,所以为阴极,根据图示,阴极反应式为[Mg2Cl2]2++4e-=2Mg+4Cl-,故A错误;
B.充电时,Mg箔上得电子发生还原反应,为电解池阴极,与电源的负极相连,故B错误;
C.放电时为原电池,原电池中阳离子向正极迁移,Mg箔为负极,Mo箔为正极,所以钠离子通过离子交换膜从右室移向左室,故C正确;
D.放电时负极反应式为2Mg+2Cl--4e-=[Mg2Cl2]2+,所以外电路中通过0.4mol电子时,有0.2molMg转化为Mg2+,负极质量变化为0.2mol×24g/mol=4.8g,故D错误;
故答案为C。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有![]() 结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合成的,其化学方程式是____________。
聚合成的,其化学方程式是____________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯(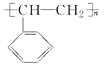 ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
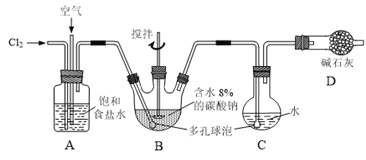
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS等)制备FeSO4·7H2O,并测定FeSO4·7H2O的纯度。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol/L的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
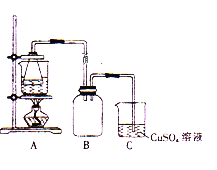
(1)步骤①用热的碳酸钠溶液浸泡的目的是____ 。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________。
(3)装置C的作用是_____________,其中有关反应的离子方程式为_____________。
(4)步骤④中洗涤时所用的洗涤剂最好是_____________。
A.稀硝酸 B.无水乙醇 C.苯
II.测定产品的纯度:
称取m g产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用c mol/L的KMnO4标准溶液滴定,消耗VmL KMnO4标准溶液。滴定过程中选用___(填“酸式”或“碱式”)滴定管,发生反应的离子方程式为________;产品的纯度为_________(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1L1mol/L食盐水中。下列说法正确的是( )
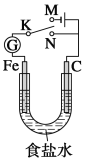
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28L(标准状况)气体时,生成了1.25molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的工业品,可用于制取卤代烃、丙醇及塑料等。回答下列问题:
(1)丙烯与HCl加成生成CH3CHClCH3或CH3CH2CH2Cl的能量与反应历程如图:
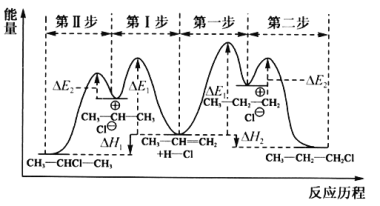
①从能量角度看,较稳定的产物是________(填“CH3CHClCH3”或“CH3CH2CH2Cl”)。
②制取CH3CHClCH3时,反应速率较慢的步骤是________(填“Ⅰ”或“Ⅱ”)。
(2)丙烷直接脱氢制丙烯的相关热化学反应如下:
主反应:C3H8(g)→C3H6(g)+H2 ΔH1=+124.27kJ·mol-1
副反应:C3H8(g)→CH4(g)+C2H4(g) ΔH2=+81.30kJ·mol-1
C3H8(g)+H2(g)→CH4(g)+C2H6(g) ΔH3=-55.64kJ·mol-1
C2H4(g)+H2(g)→C2H6(g) ΔH4
①ΔH4=_____________kJ·mol-1
②分别在0.1Mpa和0.01Mpa时,丙烷和丙烯的平衡物质的量分数如图所示:
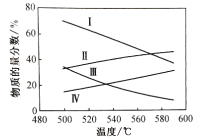
表示0.1Mpa时丙烷物质的量分数的是________(填罗马数字,下同);表示0.01Mpa时丙烯物质量的分数的是________。
(3)用二氧化碳氧化丙烷制丙烯主要反应如下:
Ⅰ.C3H8(g)![]() C3H6(g)+ H2 ΔH1>0平衡常数K1
C3H6(g)+ H2 ΔH1>0平衡常数K1
Ⅱ.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2>0平衡常数K2
CO(g)+H2O(g) ΔH2>0平衡常数K2
Ⅲ.耦合反应C3H8(g)+CO2(g)![]() C3H6(g)+CO(g)+H2O(g)
C3H6(g)+CO(g)+H2O(g)
当C3H8的物质的量一定时,按不同投料比Z[Z=![]() ]向密闭容器中充入C3H8和CO2,发生反应Ⅲ,C3H8平衡转化率随温度变化如图所示:
]向密闭容器中充入C3H8和CO2,发生反应Ⅲ,C3H8平衡转化率随温度变化如图所示:
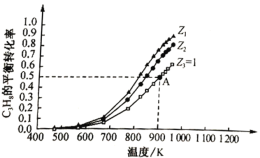
①反应Ⅲ的平衡常数K=________(用K1、K2表示)。
②Z1________(填“>”“<”“=”)Z2。原因是________
③若A点气体总压强为0.2Mpa,则丙烯的平衡分压为________MPa;900K时反应Ⅲ的平衡常数Kp=________MPa(Kp为用平衡分压表示的平衡常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com