
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化图如所示。下列说法正确的是![]()
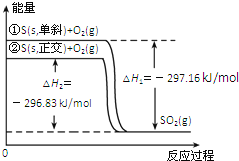
A.![]() ,单斜
,单斜![]() ,正交
,正交![]()
B.正交硫比单斜硫稳定
C.单斜硫燃烧的热化学方程式为:![]() ,单斜
,单斜![]()
D.![]() 式表示断裂1
式表示断裂1 ![]() 中的共价键所吸收的能量比形成1
中的共价键所吸收的能量比形成1 ![]() 中的共价键所放出的能量少
中的共价键所放出的能量少![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关立方烷分子式:C8H8,结构简式![]() ,下列说法不正确的是
,下列说法不正确的是
A.它的一氯代物只有一种同分异构体,其二氯代物有两种同分异构体
B.分子中存在极性键、非极性键,是一种非极性分子
C.它不是芳香烃,但与苯乙烯互为同分异构体
D.它含碳质量分数与乙炔、苯等物质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为
Si(s)+4HCl(g),该反应的反应热△H为
A. +236 kJ·mol-1B. -236 kJ·mol-1
C. +412 kJ·mol-1D. -412 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、N、P、Q四块金属片,进行如下实验:
① M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗
②P、Q用导线相连后,同时浸入稀![]() 中,Q是电子流入的一极
中,Q是电子流入的一极
③M、P相连后,同时浸入稀![]() ,P极产生大量气泡
,P极产生大量气泡
④N、Q相连后,同时浸入稀![]() 中,Q极发生氧化反应
中,Q极发生氧化反应
则四种金属的活动性顺序为
A.M>N>P>QB.M>P>Q>NC.N>Q>P>MD.P>M>N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)该反应的平衡常数表达式为________,若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 为原料生产重铬酸钠
为原料生产重铬酸钠![]() ,其流程如图1:
,其流程如图1:
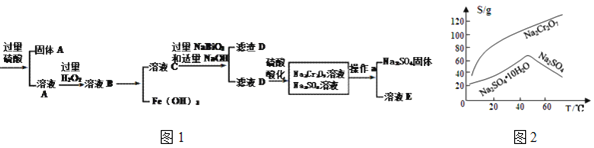
查阅资料得知:
①常温下,![]() 难溶于水,有强氧化性。
难溶于水,有强氧化性。
②常温下,![]()
③物质溶解度曲线如图2所示。
回答下列问题:
(1)![]() 铬的价态是______,
铬的价态是______,![]() 的电子式为______。
的电子式为______。
(2)![]() 的作用______。
的作用______。
(3)滤渣D的成分是______。
(4)操作a的名称是______、______。
(5)电镀厂产生的镀铜废水中往往含有一定量的![]() 处理该废水的流程为:含
处理该废水的流程为:含![]() 的废水
的废水![]() 含
含![]() 的废水
的废水![]() Cr(OH)3沉淀
Cr(OH)3沉淀
①流程中,![]() 参与反应的离子方程式______。
参与反应的离子方程式______。
②![]() ______,
______,![]() 已沉淀完全
已沉淀完全![]() 此时
此时![]() ;若
;若![]() 时,
时,![]() 开始溶解,溶解时的离子方程式为______。
开始溶解,溶解时的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的下列性质中,可以证明它是弱电解质的是( )
![]() 大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;
大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;![]() 醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
A.②④⑤⑥B.②④⑥C.①②④D.②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com