
在体积相同的三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度与密度都相同时,这三种气体的分子数(N)从大到小的顺序是( )
A. N(Ne)>N(H2)>N(O2) B. N(O2)>N(Ne)>N(H2)
C. N(H2)>N(O2)>N(Ne) D. N(H2)>N(Ne)>N(O2)
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 在接触室里用98.3%的浓硫酸吸收SO3,目的是防止形成酸雾便于SO3吸收完全
B. 工业制玻璃和炼铁过程中都要加入石灰石,目的是除去杂质二氧化硅
C. 工业上用金属钠与TiCl4溶液在高温下反应,目的是将金属钛从氯化物中置换出来
D. 海水中提取镁的过程中加入贝壳煅烧制得的石灰,目的是将Mg2+转变成Mg(OH)2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
下列有关溶液中微粒浓度关系的叙述正确的是( )
A. 物质的量浓度相等的HCN和NaCN的混合液(pH>7) 中:c(Na+)>c(CN-)>c(HCN)>c(OH-)
B. 在pH=7的NH4Cl和NH3?H2O的混合溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.1mol?L-1的(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
D. 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L HF中含有的电子数为10NA
B. 在一定条件下,1molSO2和0.5molO2在密闭容器中充分反应,转移电子数目为2NA
C. 常温常压下,32gN2H4中含有的共价键数目为5NA
D. 某饱和FeCl3溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:实验题
某同学按下列步骤配制500 mL 0.20 mol·L-1KCl溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需KCl的质量 |
|
(2)称量KCl固体 | 称量过程中主要用到的仪器是__________ |
(3)将KCl加入100 mL烧杯中,加适量蒸馏水溶解 |
|
(4)将烧杯中的溶液转移至500 mL容量瓶中,洗涤2至3次并将洗涤液转入容量瓶中 | 为防止溶液溅出,应该采取的措施是______________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______________________________ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
当光束通过下列分散系:①有尘埃的空气②稀硫酸③蒸馏水④墨水,能观察到丁达尔效应的是( )
A. ①② B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:简答题
(1)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数K=
SO3(g)+NO(g)的平衡常数K=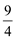 ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol·L-1 | 0.10 | 0.10 | 0.20 |
①10 min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=___________。
②丙达到平衡所用的时间_______10 min(填“<”、“>”、“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_______________。
(2)研究铁及其化合物对生产生活具有重要的意义。一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
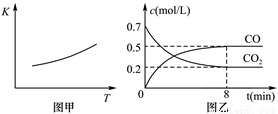
①反应ΔH__________0(填“<”或“>”)。
②下列措施中能使平衡时c(CO)/c(CO2)增大的是__________(填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
③一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。计算该反应的平衡常数K=_______。
(3)已知:CO(g)+2H2(g)=CH3OH (g) ΔH=-116 kJ·mol-1;
CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1;
H2 (g)+1/2O2(g)=H2O(g) ΔH=-242 kJ·mol-1 ;
写出CH3OH燃烧生成CO2和水蒸气的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列有关盐类水解的应用不正确的是
A. 明矾、氯化铁晶体可用于净水
B. 实验室通常可使用热的纯碱溶液去除油污
C. 实验室配制FeCl3溶液时可加入少量盐酸
D. 直接加热CuCl2溶液能得到CuCl2固体
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是
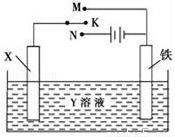
A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com