
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
【答案】D
【解析】
(1)取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为BaCO3和BaSO4,则溶液中含有CO32-、SO42-;
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石试纸变蓝的气体,说明溶液中有NH4+。
(1)取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为BaCO3和BaSO4,质量一共是4.3g.则溶液中含有CO32-、SO42-,向沉淀中加入过量的盐酸,有2.33g沉淀不溶,则硫酸钡的质量是2.33g,所以硫酸根离子的物质的量是![]() ,所以碳酸钡的质量是
,所以碳酸钡的质量是![]() ,碳酸根离子的物质的量是
,碳酸根离子的物质的量是![]() 。
。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体是氨气,物质的量是![]() ,说明溶液中有NH4+的物质的量是0.05mol;
,说明溶液中有NH4+的物质的量是0.05mol;
A.溶液中一定存在SO42-、CO32-、NH4+,根据电荷守恒,一定存在Cl-,不能确定是否存在Na+、K+,故不符合题意;
B.溶液中一定存在SO42-、CO32-、NH4+,根据电荷守恒,一定存在Cl-,不能确定是否存在Na+、K+,故不符合题意;
C.碳酸根离子的物质的量是![]() ,硫酸根离子的浓度是
,硫酸根离子的浓度是![]() ,铵根离子浓度是
,铵根离子浓度是![]() ,故不符合题意;
,故不符合题意;
D.如果上述6种离子都存在,根据电荷守恒c(Cl-)+2c(SO42-)+2c(CO32-)=c(NH4+)+c(Na+)+c(K+),则c(Cl-)> c(SO42-),故符合题意;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为___________。
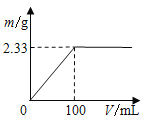
(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_____(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无水Na2CO3固体配制230mL0.1000mol·L-1的溶液。请回答:
(1)在配制过程中不必要的玻璃仪器是___。
A.烧杯 B.量筒C.玻璃棒 D.胶头滴管 E.容量瓶
(2)定容时的操作:当液面接近容量瓶刻度线时,__,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(3)下列操作会使配得的Na2CO3溶液浓度偏低的是___。
A.称取相同质量的Na2CO3·10H2O固体进行配制
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法。
(1)图I是实验室制取蒸馏水的常用装置,图中明显的错误是_________________。
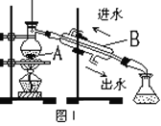
(2)仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入少量__________。
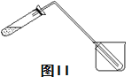
(4)图II装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是 ______________________;烧杯中还应盛有的物质是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )

A. X2R 溶液的浓度为0.03mol·L-1
B. 最简单气态氢化物的稳定性:Y>Z>R
C. 工业上通常采用电解法冶炼Q的单质
D. RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. 酸性强弱顺序是:HCOOH > HCN > H2CO3
B. 物质的量浓度均为0.1 mol·L-1的HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa < NaCN
C. HCOOH的电离平衡常数表达式为K=![]()
D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3 + 2CN- = 2HCN + CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2X(g) ![]() Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
化情况如下表:
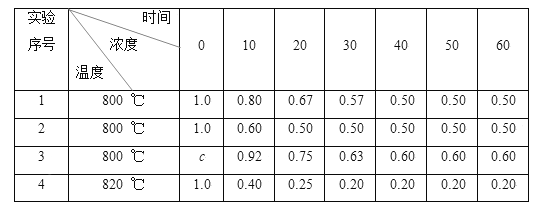
下列说法不正确的是( )
A. c>1.0 B. 实验2可能使用了催化剂
C. 实验3比实验2先达到化学平衡状态 D. 前10分钟,实验4的平均化学反应速率比实验1的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com