
科目: 来源: 题型:
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:
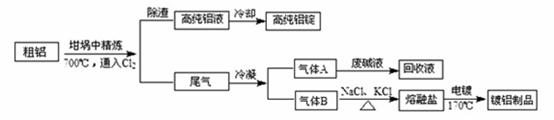
(注 :NaCl熔点为801℃;AlCl3在181℃升华)
:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和② 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为 。
(4)镀铝电解池中,金属铝为 极,熔融盐电镀中铝元素和氯元素主要以AlCl4― 和Al2Cl7―形式存在,铝电镀的主要电极反应式为 。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的
Fe3+ +H2O的 平衡常数K=_____________。
平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目: 来源: 题型:
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A. Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性
C. Li、Na、K的原子半价和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
查看答案和解析>>
科目: 来源: 题型:
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、Fe Cl3、CuCl2均不能采用将溶液直接蒸干的方法
Cl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目: 来源: 题型:
某同学通过系列实验探究Mg及其化合物的性质, 操作正确且能达到目的的是
操作正确且能达到目的的是
A、将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B、将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C 、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D、将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
查看答案和解析>>
科目: 来源: 题型:
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| 选项 化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | C2H5OH | FeCl3 |
| W | MgO | Al2O3 | C2H5ONa | CuCl2 |
查看答案和解析>>
科目: 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,建中b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
查看答案和解析>>
科目: 来源: 题型:
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①反应的化学方程式为 ;
②0~10s内,用Z表示的化学反应速率 ;
③X的转化率为 ;(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比)
(2)在一定温度下,可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志是
A.A的生成速率与C分解的速率相等
B.单位时间内生成nmolA,同时生3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com