
科目: 来源:2016届安徽省皖江名校高三上学期12月联考化学试卷(解析版) 题型:填空题
CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益.
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-820kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H3=-566kJ/mol
则反应的CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)工业上,可利用太阳能以CO2为原料制取C,其原理如下图所示:
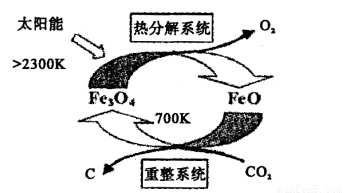
整个过程中__________(填“Fe3O4”或“FeO”)是反应的催化剂。重整系统中发生的反应为6FeO+CO2 2Fe2O3+C,每生成1molFe3O4,转移电子的物质的量为____________。
2Fe2O3+C,每生成1molFe3O4,转移电子的物质的量为____________。
(3)CO2还可用于合成甲醇,其热化学方程式为:CO2(g)+H2(g) CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
①该反应的平衡常数表达式为____。
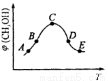
②在恒容的密闭容器中,加入H2和CO2的混合气体,不同温度条件,反应相同时间后,测得甲醇的体积分数甲(CH3OH)如图所示。图中A、B、C、D、E五个点对应的状态中,处于平衡状态的是 _______ (填字母),B点和E点的反应速率大小关系为v(B) v(E)(填“>”、“<”、“=”)。
③一定温度下,在甲、乙两个容积相同的密闭容器中,加入H2和CO2的混合气体。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g) |
甲容器平衡后气体的压强为开始时的80%,要使乙容器达平衡时与甲容器达到相同的平衡状态,且起始时反应逆向进行,则c的取值范围为___________。
查看答案和解析>>
科目: 来源:2016届安徽省皖江名校高三上学期12月联考化学试卷(解析版) 题型:填空题
锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
试管编号 | 实验现象 |
A | 溶液不变色 |
B | 溶液缓慢变浅棕褐色 |
C | 溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:

已知Fe3+、Mn2+沉淀的pH如表所示。
开始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 4.2 |
Mn2+ | 8.3 | 10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
下列实验不合理的是( )

A B C D
A.证明非金属性强弱 S>C>Si B.四氯化碳萃取碘水中的碘
C.制备并收集少量NO气体 D.制备少量氧气
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
下列有关物质分类和氧化还原的描述正确的是( )
A.酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
B.元素的单质可由氧化或还原含该元素的化合物来制得
C.得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性
D.烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
下列相关反应的离子方程式书写错误的是
A.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO—+4OH—+2Fe(OH)3=3Cl—+5H2O+2FeO42—
B.少量SO2通入苯酚钠溶液中:2C6H5O—+SO2+H2O=2C6H5OH+SO32—
C.用稀硫酸酸化的KMnO4溶液与H2O2反应:2MnO4—+6H++5H2O2=2Mn2++5O2↑+8H2O
D.少量SO2通入NaClO溶液中:SO2+ClO—+OH—=SO42—+Cl—+H+
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
下列物质提纯的方法正确的是
A.除去混在NO2中的NO:将气体与足量O2混合
B.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中混有的乙醇:加入生石灰后蒸馏
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是

A.工业上通过电解熔融状态MgCl2制取金属镁
B.在第②、④步骤中,溴元素均被氧化
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
某学习兴趣小组讨论辨析以下说法,其中说法正确的是
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物.
A.③⑤⑥ B.①② C.③⑤ D.①③④
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是
A.KNO3是还原剂,其中N元素被氧化
B.生成物中的N2是氧化产物,K2O是还原产物
C.若有65 g NaN3参加反应,则被氧化N的物质的量为3.2mol
D.每转移1 mole﹣,可生成标准状况下N2的体积为35.84L
查看答案和解析>>
科目: 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
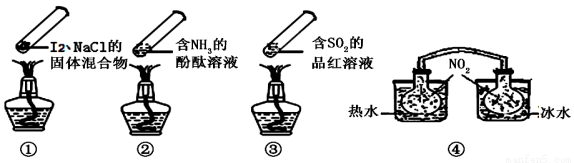
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com