
科目: 来源:2016届湖南省十校共同体高三上学期12月联考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数。下列说法中错误的是
A.标准状况下,22.4L由H2和O2组成的混合气体,所含分子总数为NA
B.1molCl2参加反应,转移的电子数一定为2NA
C.常温常压下,1mol氖气含有的原子数为NA
D.1L1mol/LFeCl3溶液中Fe3+的数目小于NA
查看答案和解析>>
科目: 来源:2016届湖南省十校共同体高三上学期12月联考化学试卷(解析版) 题型:选择题
已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) △H=+468.2 kJ. mol-l;
C(s) +O2 (g)=CO2 (g) △H=-393.5 kJ. mol-1;则4Fe(s)+3O2(g)=2Fe2O3(s)的△H是
A. -1648.7 kJ.mo1-1 B.-1255.3 kJ. mol-1
C.-861.7 kJ. mol-l D. +867.1 kJ. mol-1
查看答案和解析>>
科目: 来源:2016届湖南省十校共同体高三上学期12月联考化学试卷(解析版) 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.该法的工艺流程为
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显____________色.
(2)能说明第①步反应达平衡状态的是________________
a.2v正(Cr2O72-)=v逆(CrO42-)
b.Cr2O72-和CrO42-的浓度相同
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4•7H2O,
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至____________
方法2:电解法.
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为__________
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)____________,溶液中同时生成的沉淀还有_________。
查看答案和解析>>
科目: 来源:2016届湖北省枣阳市高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
用 NA表示阿伏加德罗常数的值。下列说法正确的是
A.7.8 g Na2O2中含有的阴离子数目为0.2NA
B.3.2 g O2和O3的混合气中含有的氧原子数目为0.2NA
C.1mol N2与3mol H2混合充分反应,转移的电子数目为6NA
D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2NA
查看答案和解析>>
科目: 来源:2016届湖北省枣阳市高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
下列所采取的分离方法正确的是
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精
C.可用冷却热的饱和氯化钾和氯化钠混合溶液的方法得到纯净的氯化钠晶体
D.由于胶体微粒的直径比离子大,所以碘化钾混入淀粉中可用渗析法分离
查看答案和解析>>
科目: 来源:2016届湖北省枣阳市高三上学期第四次月考理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。F原子核外最外层电子数与Na相同,其余各层电子均充满。
(1)E3+的价电子排布式为 。
(2)AB32— 的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22— 与B22+ 互为等电子体,B22+的电子式可表示为 ___________,1mol B22+ 中含有的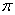 键数目为 。
键数目为 。
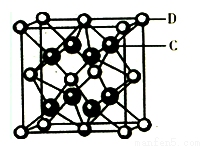
(4化合物DC2的晶胞结构如右图所示,形成的离子化合物的电子式为__________该离子化合物晶体的密度为a g/cm3,则晶胞的体积是 ____ cm3(只要求列算式,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目: 来源:2016届广东省七校联合体高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
下列离子反应方程式正确的是
A.向Ca(HCO3)2溶液加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.向NH4HCO3溶液中滴入少量NaOH溶液:NH4++OH-=NH3·H2O
C. FeSO4 溶液在空气中变黄色:4Fe2++O2+4H+=4Fe3++2H2O
D.用NaOH溶液吸收NO2气体:3NO2+2NaOH=2NaNO3+NO↑+H2O
查看答案和解析>>
科目: 来源:2016届广东省七校联合体高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
下列分离或提纯有机物的方法正确的是
选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
A | 乙烷 | 乙烯 | 酸性KMnO4溶液,洗气 |
B | MgCl2溶液 | FeCl3 | MgO,过滤 |
C | HCl气体 | Cl2 | 饱和食盐水,洗气 |
D | 乙醇 | 水 | 生石灰,过滤 |
查看答案和解析>>
科目: 来源:2016届广东省七校联合体高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
某硫酸厂用以下几种方法处理SO2尾气。
(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。反应进行到不同时间测得各物质的浓度如图:
S2(g)+2CO2(g) 。反应进行到不同时间测得各物质的浓度如图:

①第一次出现平衡的时间是第 min;
②0~20min反应速率表示为V(SO2)= ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ; 40min时,平衡常数值为__________。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为 ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__________(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
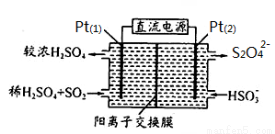
如右图所示,Pt(1)电极的反应式为 ;
碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体 mol。
查看答案和解析>>
科目: 来源:2016届广东省东莞市六校高三上学期联考理综化学试卷(解析版) 题型:选择题
化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com