
科目: 来源: 题型:选择题
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
| A. | Cu和Na | B. | Fe和Cu | C. | Cu与Al | D. | Al与Na |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | C( F-)<C(CN-) |
查看答案和解析>>
科目: 来源: 题型:解答题
 命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
(1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
查看答案和解析>>
科目: 来源: 题型:解答题
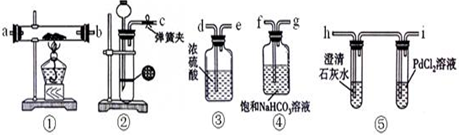
查看答案和解析>>
科目: 来源: 题型:填空题
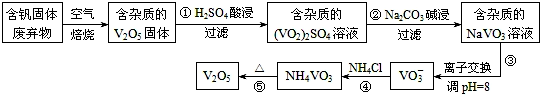
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
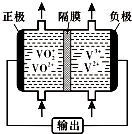
查看答案和解析>>
科目: 来源: 题型:选择题
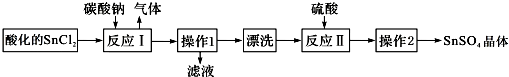
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+═CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2-3次 | |
| D. | 操作1为过滤,操作2为盐析 |
查看答案和解析>>
科目: 来源: 题型:解答题
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
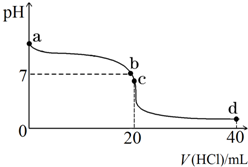 室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com