
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
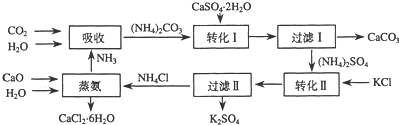
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目: 来源: 题型:填空题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目: 来源: 题型:填空题
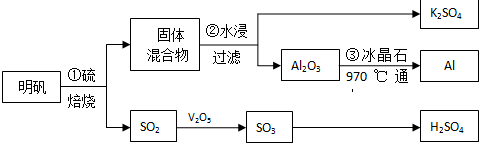
查看答案和解析>>
科目: 来源: 题型:填空题
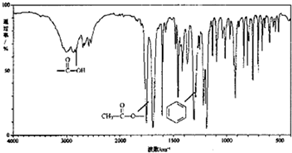 有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图:
有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图: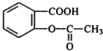 .
.查看答案和解析>>
科目: 来源: 题型:解答题
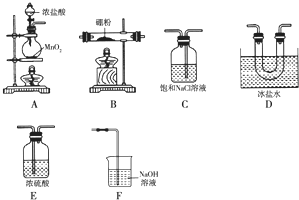
查看答案和解析>>
科目: 来源: 题型:选择题
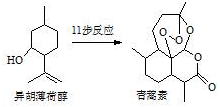 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有5个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
科目: 来源: 题型:解答题
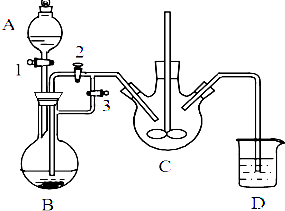 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目: 来源: 题型:解答题

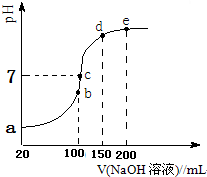
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 离子半径:Na+>Al3+ | |
| B. | 铝钠合金若投入一定水中可得无色溶液并产生气泡 | |
| C. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com