
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
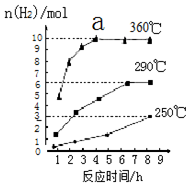 磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: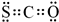 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L•min) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
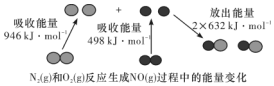
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
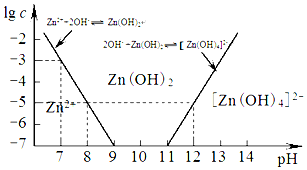
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
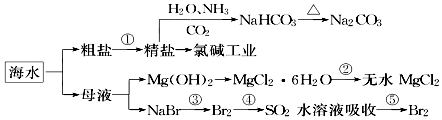
 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com