
科目: 来源: 题型:选择题
| A. | 用淀粉KI试纸鉴别溴蒸气和NO2气体 | |
| B. | 证明Fe2O3是碱性氧化物,可将其与盐酸混合,观察现象 | |
| C. | 若NaOH溶液不慎沾到皮肤上,应该立即用大量的硫酸清洗 | |
| D. | 除去MnO2中的杂质KMnO4,可将固体溶于水后过滤 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2、CH4、氟氯代烃等都会造成温窒效应,因此都属于大气污染物 | |
| B. | 测定某地区的酸雨发现经过一段时间之后pH下降,判断为硝酸型酸雨 | |
| C. | 低碳经济主要与工厂、汽车排放有关,与人们用电、用水、用纸等是否节约无关 | |
| D. | 绿色化学的核心是利用化学原理对环境污染进行治理 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

查看答案和解析>>
科目: 来源: 题型:解答题
 2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下:
2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下:
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| B. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 | |
| C. | “84”消毒液主要成分为次氯酸钠,与适量白醋混合使用消毒效果会更好 | |
| D. | 夏季马路喷洒氯化钙溶液,氯化钙跟水分子结合形成结晶水合物起到保湿作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | |||||
| Z | Y | M | N |
| A. | N的含氧酸一定是强酸 | B. | 单质Z比单质Y活泼 | ||
| C. | X的原子半径比Y的小 | D. | X和M的原子序数相差10 |
查看答案和解析>>
科目: 来源: 题型:推断题

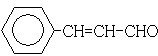 ;
;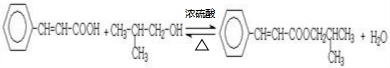 .
.查看答案和解析>>
科目: 来源: 题型:解答题
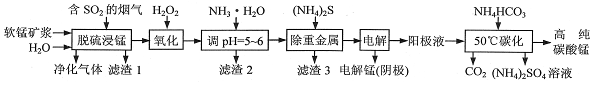
查看答案和解析>>
科目: 来源: 题型:实验题
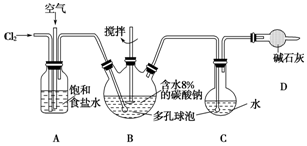
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com