
科目: 来源: 题型:解答题
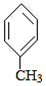 +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$ $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$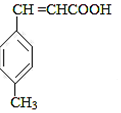 $→_{浓硫酸,△}^{CH_{3}OH}$E
$→_{浓硫酸,△}^{CH_{3}OH}$E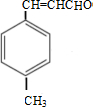 ,生成E的反应类型为酯化反应或取代反应
,生成E的反应类型为酯化反应或取代反应 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为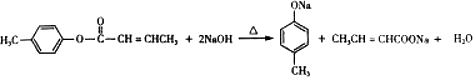 .
.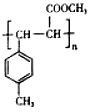 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 溶质 溶解度 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 170 | 9.2 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①的平衡常数K1=$\frac{c(C{O}_{2})•c(Cu)}{c(CO)•c(CuO)}$ | |
| B. | 反应③的平衡常数K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 | |
| D. | 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+、K+、NO3-、Cl- | B. | K+、Na+、HCO3-、Cl- | ||
| C. | Na+、CO32-、SO42-、NO3- | D. | Ba2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 太阳能、氢能、风能、地热能、海洋能和生物质能等属于新能源 | |
| B. | 根据能量守恒定律,生成物总能量一定等于反应物总能量 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 吸热反应在常温下一定不能发生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A. | 平衡时,Ⅰ、Ⅱ中反应的转化率α(N2O4)>α(NO2) | |
| B. | 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) | |
| C. | 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=$\frac{Ⅰ}{K(Ⅱ)}$ | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t 1 | t 2 | ||
查看答案和解析>>
科目: 来源: 题型:选择题
| 1.0 MPa | 2.0 MPa | 3.0 MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25% | B. | 40% | C. | 60% | D. | 75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com