
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
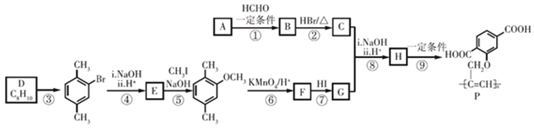
 $\stackrel{一定条件}{→}$R-C≡
$\stackrel{一定条件}{→}$R-C≡
 +CH2I$\stackrel{NaOH}{→}$
+CH2I$\stackrel{NaOH}{→}$ +NaI+H2O
+NaI+H2O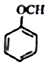 +HI→
+HI→ +CH2I
+CH2I .
. .
.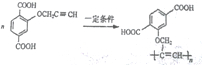 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
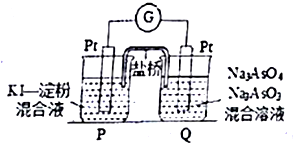
 某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )
某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | H+由质子交换膜右侧向左侧迁移 | |
| C. | 每消耗标况下5.6LO2,电路中通过1 mol电子 | |
| D. | 铂电极的电极反应式:C8H18+16H20-5Oe-═8CO2↑+50H+ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 元素C、D、E的最高价氧化物对应的水化物之间两两都可以发生反应 | |
| B. | 1mol由元素A、B组成且含有18 mol e-的化合物只有一种 | |
| C. | 含D元素的盐溶液只能显酸性,不可能显碱性 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com