
科目: 来源: 题型:选择题
 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH)3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验A | 条件 | 现象 |
 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
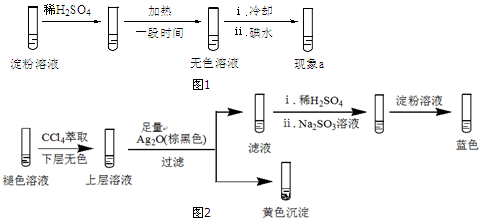
查看答案和解析>>
科目: 来源: 题型:实验题
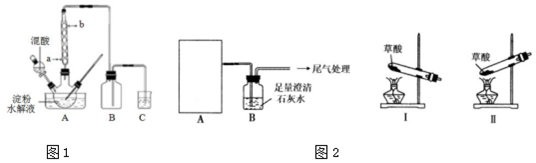
查看答案和解析>>
科目: 来源: 题型:解答题
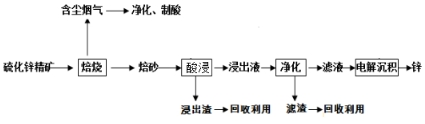
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | a端是直流电源的负极 | |
| B. | 通电使CuCl2发生电离 | |
| C. | 阴极上发生的反应:Cu2++2e-=Cu | |
| D. | 通电后,在阳极附近可观察到黄绿色气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体颜色变浅 | B. | 逆反应速率加快 | ||
| C. | NO2转化率增大 | D. | 气体平均分子量变大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时Kw=1.0×10-14,将稀硫酸加热至90℃(忽略溶液体积变化)其pH不变 | |
| B. | pH与体积都相同的醋酸和硝酸溶液分别用0.1mol•L-1氢氧化钠溶液恰好中和,所需的氢氧化钠溶液体积前者一定大于后者 | |
| C. | 0.2 mol•L-1CH3COONa溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-) | |
| D. | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,即说明Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.15 mol/L | C. | 0.25 mol/L | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜长期放置在潮湿的空气中容易生锈,生成Cu(OH)2 | |
| B. | 铜丝在氯气中燃烧生成CuCl2而与硫反应生成Cu2S,说明氧化性Cl2>S | |
| C. | CuO不及Cu2O稳定,高温条件下CuO可以分解生成Cu2O和氧气 | |
| D. | 蓝色的CuSO4•5H2O可以受热分解转化为白色的CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com