
科目: 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是
实验目的 | 实验操作 | |
A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
查看答案和解析>>
科目: 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏伽德罗常数的值。下列说法正确的是
A.该氯原子的相对原子质量为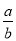
B.mg该氯原子的物质的量为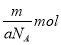
C.该氯原子的摩尔质量为aNAg
D.ag该氯原子所含的电子数为17mol
查看答案和解析>>
科目: 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:实验题
现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
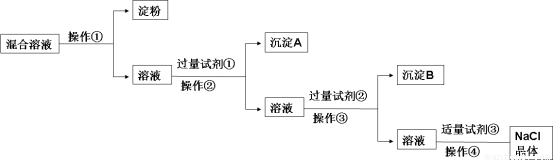
(1)操作①是利用胶体不能通过 而把淀粉胶体和溶液进行分离。
(2)写出上述实验过程中所用试剂的化学式:
试剂①___________________;试剂③_____________________。
(3)判断试剂①已过量的操作是:__________________。
(4)控制试剂③适量的方法是:__________________。
(5)试剂②的作用(用化学方程式表示):__________________。
查看答案和解析>>
科目: 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:实验题
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如下:
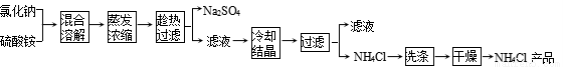
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分【解析】
NH4Cl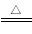 NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如下图所示:
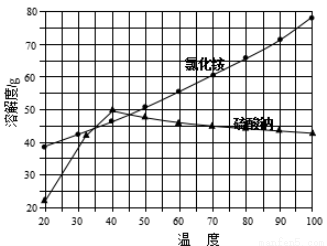
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: 。
(2)欲制备10.7 g NH4Cl,理论上需NaCl质量为 g。
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 。
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
查看答案和解析>>
科目: 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:实验题
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ、金属Ca的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca+H2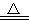 CaH2(固体)
CaH2(固体)
Ⅱ、固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑;②CaH2要密封保存。
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出Ca常温遇水发生反应的化学方程式: 。
(2)B、D中所盛试剂相同,该试剂为 (填名称);D中该试剂的作用是 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: 。
【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2 样品,按图所示连接仪器(固定装置略)。

步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL。
(4)若该实验条件下的气体摩尔体积为Vm L/mol,当V= mL时(用m、Vm表示),表明制得的CaH2样品是纯净的。
查看答案和解析>>
科目: 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:填空题
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 mol•L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上半期考试化学卷(解析版) 题型:选择题
在25℃、101kPa下,1g甲 醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ O2(g
O2(g )=CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol
)=CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=+1452 kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上半期考试化学卷(解析版) 题型:选择题
已知反应①101kPa时,2C(s)+O2(g)==2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol下列结论不正确的是 ( )
A.碳的燃烧热大于110.5 kJ/mol
B.①反应的焓变为-221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上半期考试化学卷(解析版) 题型:选择题
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 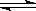 1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平
1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平 衡后,为提高该反应的速率和NO的转化率
衡后,为提高该反应的速率和NO的转化率 ,采取的正确措施是( )
,采取的正确措施是( )
A 加催化剂同时升高温度 B 加催化剂同时增大压强
C 升高温度同时充入N2 D 降低温度同时增大 压强
压强
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上半期考试化学卷(解析版) 题型:选择题
从下列事实,找出不能用勒沙特列原理解释的是( )
A.溴水中存在如下平衡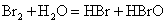 ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对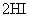

 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应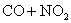

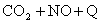 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应: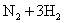

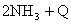 ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com