
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
一定条件下存在反应:H2(g)+I2(g) 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C.容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g) 3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是

A.升高温度,平衡常数增大
B.W点X的正反应速率小于M点X的正反应速率
C.Q点时,Y的转化率最小
D.平衡时充入Z,达新平衡时Z的体积分数比原来大
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,工作原理如图所示.下列说法错误的是
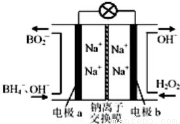
A.电池放电时Na+从a极区移向b极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗3molH2O2,转移的电子为3mol
D.该电池的a极反应为:BH4-+8OH--8e-═BO2-+6H2O
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是
A.B的转化率为20%
B.平衡时A的浓度为1.50mol/L
C.x=1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
反应A2+B2 2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
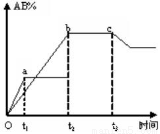
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
已知:可逆反应N2(g)+3H2(g)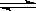 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
A.达平衡时甲中NH3的体积分数为75%
B.达平衡时甲、乙中NH3的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25molN2(g)、0.75molH2(g)和1.5molNH3(g),平衡向生成NH3的方向移动
D.乙中反应的热化学方程式为2NH3(g)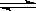 N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:实验题
某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
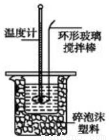
取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
(1)写出该反应的热化学方程式为___________(中和热为57.3kJ/mol);
(2)①请填写下表中的空白:
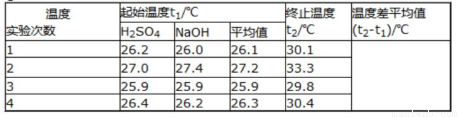
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃)。则中和热△H=___________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___________(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)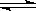 N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
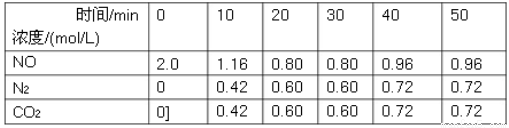
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(N2)=________mol/(L•min);计算该反应的平衡常数K=___________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是________(填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率________(填“升高”或“降低”),ΔH________0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)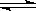 CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
2CH3OH(g)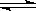 CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式__________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:__________________
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
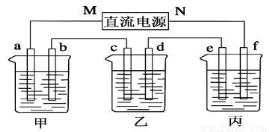
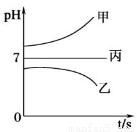
(1)M为电源的_______________极(填“正”或“负”),电极b上发生的电极反应为_____________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应___________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com