
科目: 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
(1)将等质量的Zn粉分别投入:a: 10ml0.1mol/L HCl和b: 10mL 0.1mol·L﹣1醋酸中。
①若Zn过量,产生H2的量:a b(填“>、<或=”,下同)
②若Zn不足量,则反应速率:a b
(2)将等质量Zn粉分别投入pH=1体积均为10mL的a:盐酸和b:醋酸中。
①若Zn过量,产生H2的量:a b
②若Zn不足量,则起始反应速率:a b
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视.
(1)医学上进行钡餐透视时为什么不用BaCO3? (用离子方程式表示) .
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
A.5mL水;
B.40mL 0.2mol•L-1Ba(OH)2溶液;
C.20mL 0.5mol•L-1Na2SO4溶液;
D.40mL 0.1mol•L-1H2SO4溶液中,溶解至饱和.
①以上各溶液中,Ba2+的浓度由大到小的顺序为 .
A.b>a>c>d B.b>a>d>c
C.a>d>c>b D.a>b>d>c
②已知25℃时,Kap=1.1×10-10,上述条件下,溶液b中的SO42-浓度为 mol•L-1,溶解c中Ba2+的浓度为 mol•L-1.
③某同学取同体积的溶液b和溶液d直接混合,则混合液的pH为 (设混合溶液的体积为混合前两溶液的体积之和)
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
在常温下,下列五种溶液:
①0.1mol/L NH4Cl溶液
②0.1mol/L CH3COONH4溶液
③ 0.1mol/L NH4HSO4溶液
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合溶液
⑤0.1mol/L NH3·H2O溶液
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 (填序号)
(2)比较溶液②、③中c(NH4+)的大小关系是② ③(填“>”、“<”或“=”)
(3)在溶液④中, 的浓度为0.1mol/L;NH3·H2O和 的物质的量浓度之和为0.2 mol/L
(4)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_________(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验编号 | HA物质的量浓度/ | NaOH物质的量浓度/ | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?____________.
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系____________.
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是____________.
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_________mol•L-1.
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数。回答下列问题:
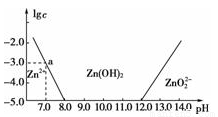
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为__________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是________。
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。
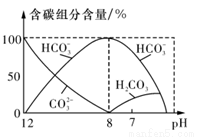
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
N2H4是一种高效清洁的火箭燃料。已知0.5molN2H4(g)完全燃烧生成氨气和气态水时,放出267kJ热量.则下列热化学方程中正确的是
A.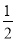 N2H4(g)+
N2H4(g)+ O2(g)=
O2(g)= N2(g)+H2O(g) △H=+267kJ/mol
N2(g)+H2O(g) △H=+267kJ/mol
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ/mol
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJ/mol
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
C.稀溶液中:H+(aq)+OH-(aq)==H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含lmol
NaOH的稀溶液混合,放出的热量大于57.3kJ
D.25℃101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ的热量,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g) = 2H2O(l);△H=-571.6kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸溶液的浓度和体积 ; ②碱溶液的浓度和体积 ;③比热容;④反应后溶液的质量;⑤ 生成水的物质的量;⑥反应前后温度的变化; ⑦操作所需的时间。
A.①②③⑥ B.③④⑤⑥ C.①③④⑤ D.全部
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列事实中,不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com