
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列说法正确的是
①1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
②过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
③密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
④235g核素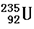 发生裂变反应:
发生裂变反应: ,净产生的中子(
,净产生的中子( )数为10NA
)数为10NA
⑤氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
⑥铜粉溶于1L0.5mol/L稀硝酸中,当生成标况下2.24LNO时,溶液中的氮原子数为0.4NA个
⑦标准状况下,11.2 升氯气溶于水,转移电子数为0.5 NA
升氯气溶于水,转移电子数为0.5 NA
⑧12g石墨和C60的混合物中质子总数一定为6NA
⑨25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子
A.②⑥⑧ B.①②⑥ C.③⑦⑧ D.①⑤⑨
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:选择题
往2L密闭容器中充入NO2,在三种不同条件下发生反应: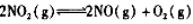
实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。

下列说法正确的是
A.实验2比实验1的反应容器体积减小
B.实验2比实验l使用了效率更高的催化剂
C.实验2和实验3可判断该反应是放热反应
D.实验1比实验3的平衡常数大
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:选择题
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )

a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | N2 | NO | NO2 | HNO3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Na | NaOH | Na2CO3 | NaHCO3 |
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:选择题
工业上以乙苯催化脱氢制取苯乙烯的反应如下:
 (g)
(g) (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定。在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示。
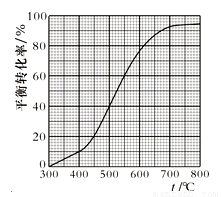
已知:气体分压(p分)= 气体总压(p总)×体积分数。不考虑副反应,下列说法正确的是
A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低
B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= × p总
× p总
D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:填空题
在一定温度下,氧化铁可以与 一氧化碳发生下列反应:
一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)①该反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速为 。
(2)说明该反应已达到平衡状态: 。
A.CO或(CO2)的生成速率与消耗速率相等
B.CO(或CO2)的质量不再改变
C.CO(或CO2)的体积分数50%
(3)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
I2(s)+5O2(g)=2I2O5(s) △H1=-75.56kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:填空题
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl 2(g)
2(g) COCl2(g) ΔH = a kJ/mol
COCl2(g) ΔH = a kJ/mol
反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比较各时段平均速率v(COCl2):
v(0-1) _________v(0-2);v(0-2) _________v(1-2) (填“>”、“=”或“<”)。
(2)在2min~4min间,v(Cl2)正_____________v(Cl2)逆 (填“>”、“=”或“<”),该温度下K =____________
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系。
X代 表的物理量是_____________;a____________0(填“>”,“=”,“<”),依据是 。
表的物理量是_____________;a____________0(填“>”,“=”,“<”),依据是 。
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:实验题
分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等。
(1) 某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:

①该实验能确认存在的阳离子是 。
②该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确的是 (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到 空气中可形成胶体
空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。

①CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 。
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:填空题
有人设想用SO2制取少量硫酸,其装置如图所示:

①H+移向 极(填“a”或“b”),c极的电极名称是 ,
②a极发生的电极反应式为 。
③c极发生的电极反应式为 。
④标准状况下,A装置吸收3.36LSO2时,B装置中溶液最多减重 g。(装置中气体的溶解性忽)不计)
查看答案和解析>>
科目: 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:实验题
“碘钟”实验中,3I-+S2O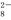 ===I
===I +2SO
+2SO 的反应速率可
的反应速率可 以用I
以用I 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O | 0.040 | 0.040 | 0.060 | 0.020[ | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是:___________________。
(2)根据①、②、⑤三个实验的数据,推测显色时间t1=____________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
a.<22.0 s b.22.0~44.0 s c.>44.0 s d.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论___________________。
查看答案和解析>>
科目: 来源:2017届湖北省高三上学期11月月考化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关,下列说法正确的是
A.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
B.通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com