
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
下列各组物质的无色溶液,不用其他试剂即可鉴别的是
①KOHNa2SO4AlCl3②Na2CO3Ba(OH)2H2SO4③HClNa[Al(OH)4]NaHSO4④Ca(OH)2Na2CO3BaCl2
A.①②
B.②③
C.①③④
D.①②④
查看答案和解析>>
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O=2Fe2++SO +4H+
+4H+
B.I2+SO2+2H2O=H2SO4+2HI
C.2Fe2++I2=2Fe3++2I-
D.H2O2+SO2=H2SO4
查看答案和解析>>
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
向KI溶液中逐滴加入少量CuSO4溶液,观察到有白色沉淀生成,溶液变为淡黄色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析中不正确的是
A.充分反应后的溶液中无Cu2+存在
B.滴加CuSO4溶液时,每生成1molCuI会转移1mole-
C.根据上述实验现象可知:Cu2+比I2的氧化性强
D.通入SO2时发生反应的离子方程式为SO2+I2+2H2O===2HI+2H++SO
查看答案和解析>>
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO
A.①③④
B.③⑦
C.③⑤
D.⑥
查看答案和解析>>
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:填空题
根据给定信息书写氧化还原方程式:(9分)
(1)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。
(2)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。
(3)在盛有10mL1.0mol·L-1的碘水的试管中,通入足量Cl2完全反应后,共转移了0.1mol电子。写出该反应的化学方程式: 。
查看答案和解析>>
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:实验题
实验室需要配制0.55mol·L-1NaOH溶液220mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、。
(2)计算。配制该溶液需取NaOH晶体。
(3)称量。
①天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置: (1g以下用游码):
(1g以下用游码):
②称量过程中NaOH晶体应放于天平的(填“左盘”或“右盘”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 。
(5)转移、洗涤。在转移时应使用玻璃棒引流,应注意;需要洗涤烧杯2~3次是为了 。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有(填字母,下同);无影响的有。
A.称量时用生锈的砝码 |
B.将NaOH放在纸上称量 |
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
D.往容量瓶转移时有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥就用来配制溶液
查看答案和解析>>
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:实验题
科学家侯德榜发明的联合制碱法(又称侯氏制碱法)主要原理是:向饱和食盐水中先后通入足量NH3和CO2,生成NaHCO3(在该混合溶液中溶解度较小),加热可得到Na2CO3。某化学小组利用如图装置进行模拟实验,A、B、C、D为备选装置。
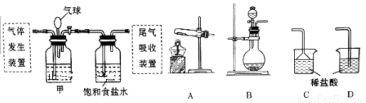
请填写下列空白:
(1)联合制碱法制取NaHCO3的化学方程式为。
(2)用石灰石和盐酸制取CO2时应选用的气体发生装置为(填字母代号,下同),该反应的离子方程式为;若制NH3选用与实验室制取CO2相同的发生装置,则应选择的试剂为(填试剂的名称)。
(3)按照如图所示的装置制备NH3,并充入NH3来制备饱和氨盐水,应选用的尾气吸收装置为(填字母代号);甲装置的作用为;该实验过程中应先通入后通入,其原因是。
(4)反应一段时间后,饱和氨盐水中析出NaHCO3晶体,从中得到纯净NaHCO3并进一步制得Na2CO3的操作名称依次是、。
查看答案和解析>>
科目: 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:填空题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在:钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。 从废料中回收氧
从废料中回收氧 化钴(CoO)工艺流程如下:
化钴(CoO)工艺流程如下:

(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为。
(2)过程Ⅱ中加入稀H 2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因。
2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是。
查看答案和解析>>
科目: 来源:2017届山东师范大学附属中学高三上第二次模拟考试化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.单质硅可用于制造光纤和太阳能电池
B.火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质
C.在常温下可用铝制容器贮藏运输浓硫酸
D.BaSO4难溶于酸,所以可以用稀盐酸和Ba(NO3)2溶液检验SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com