
科目: 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:选择题
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )
A.该温度高于25℃
B.NaHSO4的电离方程式为NaHSO4=Na++H++SO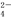
C.加入NaHSO4晶体抑制了水的电离
D.由水电离出来的H+的浓度是1.0×10-12mol·L-1
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:选择题
下列有关电解质的说法中,不正确的是( )
A. 25℃时,任何水溶液中的Kw=1.0×10-14
B. 在0.1 mol·L-1的醋酸溶液中加入少量冰醋酸,电离平衡正向移动,醋酸的电离程度增大
C. 将pH=2的盐酸稀释10倍,所得溶液的pH=3
D. 25℃时,pH=12的氨水中,OH-的物质的量浓度为0.010 mol·L-1
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:选择题
下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol•L-1HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1mol•L-1HNO2溶液稀释至10倍,pH约为2.6
A.①②③ B.①②④⑥ C.①④⑤⑥ D.全部
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:填空题
按要求完成以下的方程式:
(1)少量铁与稀硝酸反应的化学方程式:________________________。
(2)将少量的NaHCO3溶液滴入澄清石灰水时反应的离子方程式:________________________。
(3)氯气被稀NaOH溶液吸收时的离子方程式:________________________。
(4)氧化铝溶于NaOH溶液的化学方程式:________________________。
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:填空题
250℃时,以镍合金为催化剂,向4 L的恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
(1)已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1
II.CO(g)+H2O(g)=CO2(g)+H2(g)△H2
III.2CO(g)+O2(g)=2CO2(g)△H3
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H= (用含△H1,△H2和△H3的代数式表示)。
2CO(g)+2H2(g)的△H= (用含△H1,△H2和△H3的代数式表示)。
(2)此温度下,该反应的平衡常数K的值为 。
(3)此温度下,若测得某时刻各物质的浓度均为1.0 mol·L-1,此时反应正在向 进行。(选填“正反应方向”或“逆反应方向”),理由是 。
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:填空题
在773 K,体积为V L的恒温恒容的容器中,硫和氧气可以发生如下转化,其反应过程和能量的关系如图1所示。其中状态III为平衡状态。

已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
请回答下列问题:
(1)写出表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)在另一个温度和容积相同的容器中,1 mol SO2和2 mol O2充分反应,放出的热量比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)恒容条件下,对状态III采取下列措施,能使n(SO3)/n(SO2)增大的有 。
A.降低温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g) D.使用催化剂
(5)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 。
(6)图2中表示平衡混合物中SO3的含量最高的一段时间是 。
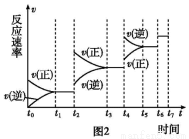
A. t1~t2 B. t3~t4 C. t5~t6 D. t6~t7
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学期期中化学试卷(解析版) 题型:实验题
某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(草酸溶液)/mL | V(蒸馏水)/mL | V(KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
(1)写出上述反应的离子方程式:________________________。
(2)上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率的影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其意义是______________________。
(3)实验①中对“乙”重复测量三次,所得数值分别13.6,13.0,13.4。据此计算,实验①中以MnO4-浓度的改变量所表示的反应速率为________________。
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学业水平测试化学卷(解析版) 题型:选择题
城市大气中铅污染的主要来源是( )
A.铅笔的随意丢弃 B.使用含铅汽油的汽车尾气
C.蓄电池的使用 D.化妆品的大量使用
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学业水平测试化学卷(解析版) 题型:选择题
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是( )
A.氧化剂 B.还原剂 C.催化剂 D.载体
查看答案和解析>>
科目: 来源:2016-2017学年广东省汕头市高二上学业水平测试化学卷(解析版) 题型:选择题
产生温室效应的原因主要是大气中含有大量的( )
A.SO2 B.NO2 C.CO2 D.CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com