
科目: 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:选择题
常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
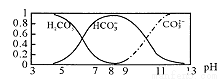
A.常温下
B.pH=13时,溶液中不存在HC03-的水解平衡
C.pH由8~11时,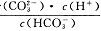 不变
不变
D.pH=3时,有
查看答案和解析>>
科目: 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:填空题
钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:
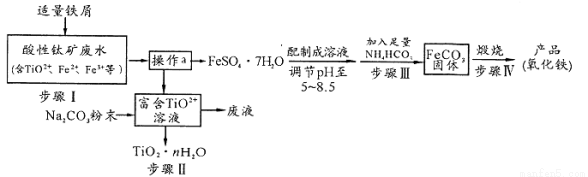
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是 。
(3)操作a是蒸发浓缩、冷却结晶、 。
(4)步骤Ⅲ中发生反应的化学方程式为____________;反应温度一般需控制在35℃以下,其目的是 。
(5)已知 s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因 。
查看答案和解析>>
科目: 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:实验题
某学习小组根据SO2的性质进行如下相关实验研究。

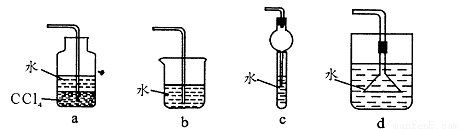
【制备SO2】按照如图装置制备SO2。
(1)A试管中可观察到的现象是 ;SO2具有漂白性,试再举出两种漂白原理互不相同的物质 。
(2)若A试管中只加浓硫酸,加热过程中,导管b出口处的气体遇见潮湿的空气会有少量“酸雾”产生。推测b处出现酸雾的主要化学反应方程式为 。
(3)SO2尾气可以用浓氨水吸收。实验室制备NH3的化学方程式为__________;下列装置中宜用于NH3制备浓氨水的是 (填序号)。

【SO2浓度检测】
(4)学生用ME3 - SO2型电化学传感器测量试管B中SO2气体浓度,工作原理如右图。电极Ⅱ的反应式为 ;当通入VmL气体时,测得SO2浓度为amol/L。此时电解液中生成的n(H+)为 ;电化学传感器灵敏度受温度影响。若高于工作温度时,测得SO2,浓度可能偏低,其原因可能是 。
查看答案和解析>>
科目: 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:填空题
CO是合成尿素、甲酸的原料。
(1)在l00kPa和TK下,由稳定单质生成1mol化合物的焓变称为该物质在TK时的标准摩尔生成焓,用符号△H0表示。已知石墨和一氧化碳的燃烧热分别为393.5kJ/mol和283.0 kJ/mol,则CO(g)的△H0=________。
(2)合成尿素的反应:2NH3(g)+CO (g)=CO(NH2)2(g)+H2(g) △H = - 81.0kJ/mol;T℃时,在体积为2L的恒容密闭容器中,将2 mol的NH3和1mol CO混合反应,5 min时,NH3的转化率为80%。则0—5min平均反应速率为v(CO)= 。

则:K1 126.5(填“>”或“< ”);其判断理由是 。若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
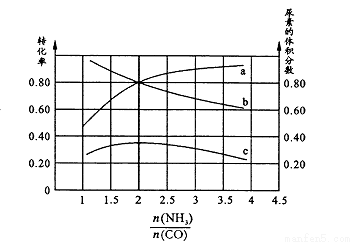
若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当 = 时,尿素含量最大;此时,对于该反虚既能增大正反应速率又能使平衡正向移动的措施是 (写一种)。
= 时,尿素含量最大;此时,对于该反虚既能增大正反应速率又能使平衡正向移动的措施是 (写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。已知常温下,浓度均为0.1 mol/L的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka= (已知lg2=0.3)。用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
①Co3+氧化HCOOH的离子方程式为 ;
②忽略体积变化,电解前后Co2+的浓度将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]已知反应
(1)基态Fe原子核外共有 种运动状态不相同的电子;Fe3+的价电子排布图为__________。
(2)NaH的电子式为 ;1mol NaOH含有的d键数目为___________,其中O原子的杂化类型为 ;Fe3+可以和SCN-形成配合物,该反应是典型的可逆反应,说明配位原子配位能力 (填“强”或“弱”)。
(3)上述反应中含Na的化合物晶体类型均为 晶体;NaH的熔点显著高于NaOH,主要原因是 。
(4)某种单质铁的晶体为体心立方堆积,则铁原子的配位数为__________;若r(Fe)表示Fe原子的半径,单质铁的原子空间利用率为 [列出含r(Fe)的计算表达式)]。
查看答案和解析>>
科目: 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:推断题
[化学——选修5:有机化学基础]有机物E是医药合成中间体。其合成路线如下:
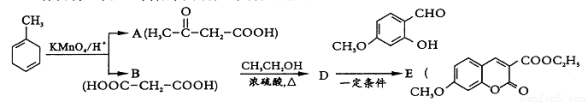
(1) 的官能团名称为____________。
的官能团名称为____________。
(2)已知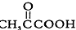 的系统命名为2-丙酮酸,则A的名称是 。
的系统命名为2-丙酮酸,则A的名称是 。
(3)D为二元酯,则B→D的化学方程式为 。
(4)D→E的反应历程如下:
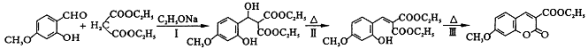
其中属于取代反应的是_________(填序号)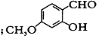 中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
(5)写出满足下列条件的D的所有同分异构体的结构简式 。
a.核磁共振氢谱有4组峰
b.常温下能与NaHCO3按1:2反应并释放出气体
(6)由化合物A经过两步便可以合成环境友好型高聚物聚3-羟基丁酸酯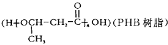 请写出反应合成线路______________。(无机试剂任用)
请写出反应合成线路______________。(无机试剂任用)
合成线路示例如下: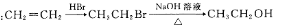
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是( )
A.该合成中所有的电能和热能全部转化为化学能
B.该合成氨过程不属于氮的固定
C.空气、水、太阳能均为可再生资源
D.断裂N2中的N≡N键会释放出能量
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
已知:Fe2O3(s)+3/2C(s)=3/2CO2(g)+2Fe(s) △H=+234.1 kJ/mol;
C(s)+O2(g)=CO2(g)△H= -393.5 kJ/mol
则2Fe(s)+3/2O2(g )=Fe2O3(s)的△H值是( )
)=Fe2O3(s)的△H值是( )
A.-824.4 kJ/mol  B.-627.6 kJ/mo
B.-627.6 kJ/mo l
l
C.-744.7 kJ/mol D.-169.4 kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
在一定温度下的固定容积的密闭容器中,发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0,能说明该反应已达平衡状态的是( )
CH3OH(g)+H2O(g) △H<0,能说明该反应已达平衡状态的是( )
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗1.2m ol H2,同时生成0.4mol H2O
ol H2,同时生成0.4mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com