
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.在硫化氢水溶液中加入碱有利于S2-的生成
B.加入催化剂有利于氨的氧化反应
C.高压有利于合成氨反应
D.向新制氯水中加入碳酸钙有利于次氯酸浓度增大
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:选择题
反应mA(s)+ nB(g) eC(g)+ fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
eC(g)+ fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是

A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,增加A的量有利于平衡向正向移动
C.化学方程式中n>e+f
D.达到平衡后,若升温,平衡正向移动
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:选择题
熔融状态下,Na的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2 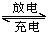 Fe+2NaCl 。下列判断不正确的是
Fe+2NaCl 。下列判断不正确的是

A.放电时,电池的正极反应式为Fe2++2e-=Fe
B.充电时,钠电极接电源的正极
C.该电池的电解质为 -Al2O3
-Al2O3
D.电池在使用时,外电路中电子由负极流向正极
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:选择题
2.0 mol PCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
A.0.40 mol B.0.20 mol
C.小于0.20 mol D.大于0.20 mol,小于0.40 mol
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:选择题
一定温度下,水中存在H2O H++OH-∆H>0的平衡,下列叙述一定正确的是
H++OH-∆H>0的平衡,下列叙述一定正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.向水中加入少量Na2SO4固体,平衡不移动,c(H+)一定为10-7 mol·L-1
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:选择题
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述一定正确的是

A.由图中信息可知HA为弱酸
B.在N点pH=7,酸碱恰好完全反应
C.常温时一定浓度的MA稀溶液显中性
D.K 点对应的溶液中,c(M+) + c(MOH)=2c (A-)
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:简答题
运用所学知识,解决下列问题:
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,试用离子方程式表示盐碱地产生碱性的原因:________________________________。
(2)今有常温下五种溶液:
NH4Cl溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 NaOH溶液
①NH4Cl溶液的pH________7(填“>”、“<”或“=”),升高温度可以_________(填“促进”或“抑制”)NH4Cl的水解;
②pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH_______NaOH溶液的pH(填“>”“= ”或“<”);
”或“<”);
③浓度相同的下列三种溶液:(A)NH4Cl溶液(B) (NH4)2SO4溶液(C)NH4HSO4 溶液,则c(NH4 +)由大到小的顺序为______>______>_______(用序号填空)。
+)由大到小的顺序为______>______>_______(用序号填空)。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,试解释原因____________________________。
(提示:SOCl2与水反应的化学方程式为SOCl2 +H2O = SO2↑+ 2HCl↑)
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:实验题
某化学小组利用硫代硫酸钠进行了相关的实验。
Ⅰ.已知:Na2S2O3 + H2 SO4 Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2 =________,V3=_______;
(2)若V4=10.0,V5=6.0,则实验①、③可探究__________对反应速率的影响。
Ⅱ.利用反应:I2+2Na2S2O3 Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
(3)滴定应选择的指示剂是_________,滴定终点的现象为____________________
________________________。
(4)对于该滴定实验的有关操作或误差分析正确的是____________。
a.滴定前,要用对应装入的溶液润洗锥形瓶和滴定管
b.滴定过程中,标准液滴到锥形瓶外, 会使所测得的结果偏大
会使所测得的结果偏大
c.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
d.滴定前仰视读数而滴定结束时平视读数,则所测得的纯度将会偏小
(5)样品中硫代硫酸钠纯度的表达式为____________。
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:填空题
根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol
冶炼铁反应的平衡常数表达式K=____________,
温度升高后,K 值________(填“增大”、“不变”或“减小”)。
(2)己知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g) ∆H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g) 2Fe(s)+3
2Fe(s)+3 CO2(g) ∆H2=-28.5kJ/mol
CO2(g) ∆H2=-28.5kJ/mol
③C(石墨)+ CO2(g)=2CO(g) ∆H3=akJ/mol
则a=__________kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知 =4)
=4)
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为___________。
②下列情况标志反应达到平衡状态正确的 是________(填字母)。
是________(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
(4)一定条件下发生反应:N2(g)+ 3H2(g) 2NH3(g)∆H<0。
2NH3(g)∆H<0。
① 在某温度时,向容积固定的容器中加入1mol N2和3mol H2,达到平衡后:
a.若向容器中通入N2,则N2的转化率将___________(填“增大”、“减小”或“不变”,下同)。
b.若再通入1mol N2和3mol H2,氮气的转化率将________。
②三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨气的体积分数随时间变化如图,下列说法正确的是___________。
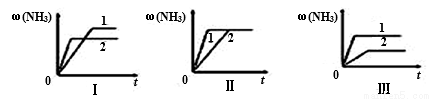
a.图Ⅰ可能是不同温度对反应的影响,且T1>T2
b.图Ⅱ可能是同温同压下有无催化剂, 1表示没加入催化剂, 2表示加入了催化剂
c.图Ⅲ可能是不同压强对反应的影响,且p1>p2
查看答案和解析>>
科目: 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:填空题
电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题。
(1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因 腐蚀而出现红棕色锈斑。试回答:
腐蚀而出现红棕色锈斑。试回答:
铁锅的锈蚀应 属于________________(填“析氢腐蚀”或“吸氧腐蚀”),铁锅锈蚀的负极反应式为:__________________;正负极反应产物会继续发生反应,最终生成的红棕色锈斑的主要成分是________________(填化学式)。
属于________________(填“析氢腐蚀”或“吸氧腐蚀”),铁锅锈蚀的负极反应式为:__________________;正负极反应产物会继续发生反应,最终生成的红棕色锈斑的主要成分是________________(填化学式)。
(2)下图是一个电化学过程的示意图。
已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
①甲池是_______装置,通O2一极的电极反应式为____________________。
②乙池中反应的化学方程式为_____________________________。如果开始加入的CuSO4溶液足量,当乙池中A(Fe)极的质量增加3.2 g时,甲池中消耗O2_________mL(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com