
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
在密闭容器中发生下列反应 aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的物质的量变多 D.a>c+d
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)  I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
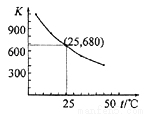
A.反应I2(aq)+I-(aq)  I3 -(aq)的ΔH>0
I3 -(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
在一定温度下,将气体 X 和气体Y各0.16 mol 充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是 ( )
A.反应前2 min 的平均速率 v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前 v(逆)>v(正)
C.该温度下此反应的平衡常数 K=1.44
D.其他条件不变,再充入 0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
观察下列几个装置示意图,有关叙述正确的是( )
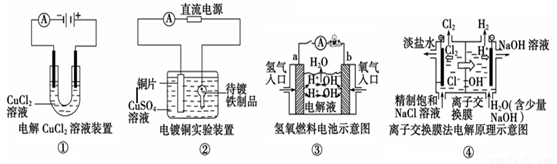
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极沿导线流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A.溶液中OH-向电极a移动
B.O2在电极b上发生还原反应
C.反应消耗的NH3与O2的物质的量之比为 4:5
D.电极 a 的反应式为 2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
下列叙述正确的是( )
A.95 ℃纯水的 pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至 10 倍后 pH=4
C.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7
D.pH 均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液电导率如图所示。下列说法不正确的是( )

A.曲线①代表滴定CH3COOH溶液的曲线
B.在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C
C.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
D.A点溶液中:c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:填空题
一种甲醇燃料电池以稀硫酸为电解液,其中一个电极上加入甲醇(CH3OH),同时另一个电极通入空气:
(1)此电池的负极反应式是__________;
(2)正极电极反应式是___________;
(3)电解液中的H+向___________极移动。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:填空题
A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多, C、D元素同主族且原子序数D 为C的二倍, E元素的价电子排布式为(n-1)dn+6ns1。回答下列问题:
(1)元素B在周期表中的位置是_______;D元素基态原子的核外电子排布式为____________。
(2)E元素能形成E+的原因是_________________________________。
(3)A 元素与C元素形成两种常见的化合物,其原子个数比为1:1 和2:1,写出其原子个数比为1:1的化合物的电子式___________。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:填空题
氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为 ______________________。
(2)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20 s内,v(NO2)=___________mol·L-1·s-1。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数数值为_____________。
④相同温度下,若开始向该容器中充入0.80molNO2,则达到平衡后: c(NO2) ______ 0.30mol·L-1(填“>”、 “=”或“<”)
(3)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
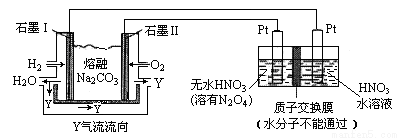
①写出石墨I电极上发生反应的电极反应式 _____________________________;
②在电解池中生成N2O5的电极反应式为 ____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com