
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O H3O++ HS-
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+ I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )




A.反应I:若p1>p2,则此反应只能在高温下自发进行
B. 反应Ⅱ:此反应的ΔH<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
下面提到的问题中,与盐的水解有关的是 ( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
④在NH4Cl溶液中加入金属镁会产生氢气
A.①③④ B.②③ C.全部 D.①②④
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化)
实验编号 | 起始浓度/(mol·L-1) | 反应后溶 液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=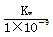 mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.20 | a |
④ | 800 | 0.10 | 0.10 | b |
下列说法正确的是 ( )
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为50%
D.实验④中,达到平衡时,b<0.05
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:推断题
A、B、D、E、Z、G、M七种元素位于元素周期表前四周期,原子序数依次增大。元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物DE2为红棕色气体,Z的单质易与水反应且只作氧化剂,G是前四周期中第一电离能最小的元素,M是第四周期元素,最外层只有一个电子,其余各层电子均充满。
请回答下列问题:
(1)元素B、D、E的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)基态G原子的价电子排布式是 ,M在元素周期表中的位置是 。
(3)元素D和Z组成分子NZ3空间构型为________;该分子为 分子(填极性或非极性),其中D原子的杂化方式为________。
(4)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙常温下,若甲、乙两溶液的pH均等于5,则由水电离出的 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为____________;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是 ;
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________。
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:填空题
今年入冬以来,简阳的雾霾较为严重,NO是引起原因之一。综合治理空气污染是环境化学当前主要研究的内容。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化。
①已知 2NO(g)+2CO(g) N2(g)+2CO2(g)反应能自发进行,则该为___________反应(填“吸热”或“放热”)。
N2(g)+2CO2(g)反应能自发进行,则该为___________反应(填“吸热”或“放热”)。
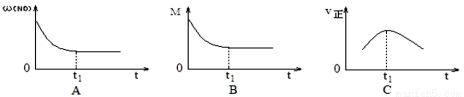
②上述反应在绝热、恒容密闭容器中进行,并在 t1时可达到平衡(图中 ω、M、v 正分别表示质量分数、混合气体平均相对分子质量和正反应速率),则下列示意图中符合题意的是___________(填选项序号)。
(2)在25℃、101kPa下,将2 mol NO、2.4 mol CO通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

①NO的转化率为 ,0~15min 内,v(NO) = 。
②20min 时若改变反应条件,导致CO浓度下降,则改变的条件可能是 (填选项序号)。
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容器体积
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:实验题
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再进行测定。
(1)在高温下将x克钢样中碳、硫转化为CO2、SO2(气体a)。
(2)将气体a通入测硫装置中(如图1),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:___________ ______。
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是_ 。
③用c mol/L 标准 NaOH 溶液滴定取出的溶液,则选择的指示剂为_________,直至加入最后一滴NaOH溶液时,溶液颜色_________,即可停止滴定。
④某次滴定前后,NaOH 溶液的液面如图2,其体积读数为________________________。若滴定3次,消耗NaOH溶液体积的平均值为z mL,则该钢样中硫的质量分数为______________________(用 x、c、z表示)。
⑤下列操作会造成测定结果偏高的是__________。
a.水洗后未用标准液润洗碱式滴定管 b.加入1 mL酸碱指示剂
c.滴定终点时,尖嘴出现气泡 d.滴定终点俯视滴定管的刻度

将气体 a 通入测碳装置中(如图),采用重量法测定碳的含量。

⑥为准确测定CO2,需除去SO2的干扰,除去SO2的装置是_______(填序号)。
⑦计算钢样中碳的质量分数,应测量的数据是__________。去掉装置E,测得碳的质量分数 (填 “偏小”、“无影响”或“偏大”)
⑧上述操作中,测定CO2前先除去SO2,但测定SO2前却没除CO2,是否合理?若不合理,说明如何改正;若合理,说明理由_____________________。
查看答案和解析>>
科目: 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:填空题
(1)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知:甲醇的燃烧热486为kJ·mol-1 ( 2CO (g) + O2(g) = 2CO2(g) △H b =-566.0 kJ·mol-1)
试写出CH3OH(l)在氧气中完全燃烧生成CO和H2O(l)的热化学方程式: 。
(2)常温下某溶液中由水电离的c(H+)=10-10 mol/L,则该溶液的pH为 _______。
(3)常温下,向V L pH=12的Ba(OH)2溶液中逐滴加入一定浓度的NaHSO4稀溶液,当溶液中的Ba2+恰好沉淀完全时,溶液pH=11。则Ba(OH)2溶液与NaHSO4溶液的体积比为__________,NaHSO4溶液的物质的量浓度为 。
(4)常温下,0.5mol/L的NH4Cl溶液的为pH=5.该溶液显酸性的原因是(用离子方程式表示) 。计算常温下氨水的电离平衡常数为 。
查看答案和解析>>
科目: 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
在多电子原子中,决定轨道能量的是
A. 电子层 B. 电子层和能级
C. 电子层、能级和原子轨道空间分布 D. 原子轨道空间分布和电子自旋方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com