
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:选择题
某体积可变的密闭容器,盛有适量的A、B混合气体,在一定条件下发生 反应A(g)+3B(g)
反应A(g)+3B(g) 2C(g)。若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
2C(g)。若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
A.原混合气体的体积为1.1VL
B. 原混合气体的体积为1.2VL
C.反应达到限度时,气体A消耗掉0.05 VL
D.反应达到限度时,气体B消耗掉0.05 VL
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康。海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)天然水净化处理过程中需要加入混凝剂,常用的混凝剂有明矾、硫酸铝、硫酸铁等,写出明矾净水作用的原理是(用离子方程式及相关语言描述)___________________。
(2)目前,国际上使用的“海水淡化”主要技术之一是电渗析法,如图是利用电渗析法对海水进行淡化处理的原理图。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为惰性电极。
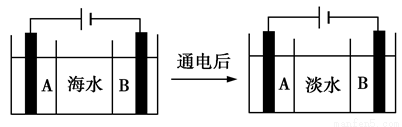
①阳离子交换膜(只允许阳离子通过)是________(填“A”或“B”);
②写出通电后阳极区的电极反应式:__________________。
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
海水电解制得的氢气可用于合成氨,某合 成氨厂生产流程如图所示:
成氨厂生产流程如图所示:

①第(1)个设备中先把N2和H2压缩的目的是_________________;
②在第(3)个设备中用冷却方法分离出____________________,其目的是__________________。
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)===BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)===Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)===BaSO4(s) ΔH=________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g) S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图像如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO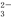 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
b.水电离出c(H+)=1×10-8 mol/L
c.c(Na+)>c(HSO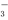 )>c(H+)>c(SO
)>c(H+)>c(SO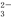 )
)
(3)电化学处理法
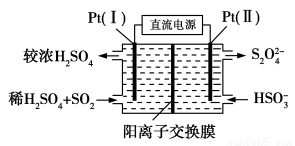
①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
已知:环丙烷、环丁烷、环戊烷在催化剂的作用和加热条件下都能与氢气发生类似的反应,如环丁烷与氢气反应可用下列反应式表示: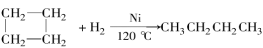
碳原子数不大于4的环烷烃可与卤素、 卤化氢发生类似反应,而碳原子数大于4的环烷烃与卤素则发生取代反应。试填空:
卤化氢发生类似反应,而碳原子数大于4的环烷烃与卤素则发生取代反应。试填空:
(1)环丙烷、环丁烷与Cl2的反应是________(填反应类型);
(2)由环丁烷和Cl2为原料制取1,3-丁二烯的方法是:首先制取_______________________(填结构简式),然后再由它通过_______________________(填反应类型)即得到1,3-丁二烯。
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:实验题
已知浓硫酸和乙醇的混合液加热后可以产生乙烯。为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:将生成的气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。乙同学在甲同学的实验中,发现褪色后的溶液中有硫酸根离子,推测在制得的乙烯中还可能有少量还原性气体杂质,由此他提出必须先除去还原性杂质,再与溴水反应。
(1)甲同学实验中溴水褪色的主要化学方程式为__________________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,理由是
________。
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴 水褪色的物质未必是乙烯
水褪色的物质未必是乙烯
d.使溴水褪色的物质就是乙烯
(3)乙同学推测乙烯中必定含有的一种气体,可以用________(填试剂名称)来验证,这种气体与溴水反应的化学方程式是______________________________。
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:推断题
迷迭香酸(F)的结构简式为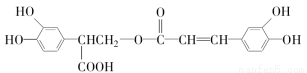
它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效。以A为原料合成F的路线如图所示(已知苯环上的羟基很难直接与羧酸发生酯化反应):

根据题意回答下列问题:
(1)A的结构简式为__________________;反应②的反应类型是__________________。
(2)反应③的试剂为__________________。
(3)1 mol F分别与足量的溴水和NaOH溶液反应,最多可消耗Br2________mol、NaOH________mol。
(4)E在一定条件下发生缩聚反应的化学方程式是__________________。
(5)与E互为同分异构体,且同时满足下列条件的有机物有________种。
①苯环上有四个取代基,且苯环上的一氯取代物只有一种;
②1 mol该物质分别与NaHCO3、Na2CO3反应时,最多消耗NaHCO3、Na2CO3的量分别是1 mol和4 mol。
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:选择题
化合物A是一种新型锅炉水除氧剂,其结构式如图所示,下列说法中正确的是( )
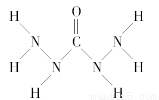
A.A中氧元素非金属性最强,故只有氧元素显负价
B.由A中的四种元素组成的化合物可能是离子化合物
C.A分子中存在两类共价键
D.A分子中氮原子没有孤电子对而氧原子有
查看答案和解析>>
科目: 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1。
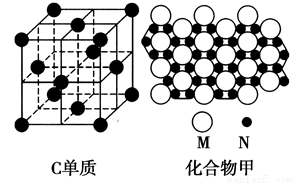
(1)A基态原子的电子排布式为__________________。
(2)一氧化碳(与N2互为等电子体)分子中σ键与π键数目之比为________。
(3)C的单质和某化合物甲的微观部分结构分别如图所示,C微粒周围等距离且距离最近的C微粒有________个;甲的化学式为________(用M、N表示)。
(4)金属C在加热时与B的最高价氧化物对应水化物的浓溶液反应的化学方程式为____________。
(5)C元素的最高价氧化物的水化物能溶于氨水,该反应的化学方程式为__________________。
(6)联氨(N2H4)是航天飞船常用的高能燃料,可以用尿素为原料制取,方法是在KMnO4催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、NaOH溶液反应生成联氨、Na2CO3、H2O及另外一种产物,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com