
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物, Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
由二氧化硅制高纯硅的流程如下,下列判断中错误的是

A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论,以下几种类比推理结论中正确的是
A. H2SO4为强酸,推出HClO4为强酸
B. Fe3Cl8可以改写为FeCl2·2FeCl3,推出Fe3I8可以改写为FeI2·2FeI3
C. NH3的沸点高于PH3,推出CH4沸点高于SiH4
D. CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
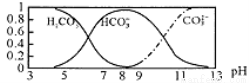
A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D. pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列说法正确的是

A. a为直流电源的负极
B. 阴极的电极反应式为:2HSO3-+2H2O+2e-=S2O42-+2OH-
C. 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:推断题
A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
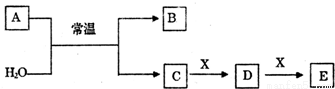
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:_______________.
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为________________.
②X可能为____________(填代号).
a.NaHCO3 b.Na2CO3 c.Na2SO3 d.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时转移的电子数目为________________.
②A的电子式为____________________。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为______(填代号).
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红.
则A与H2O反应的化学反应方程式为______.E是__________(填化学式)。
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:实验题
氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是__________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
【方案2】用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
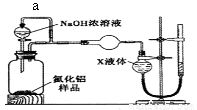
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
A.CCl4 B.H2O C.NH4Cl溶液 D.
(6)若m g样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则A1N的质量分数为_____________(用含V、m的代数式表示)。
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:实验题
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是________。完成酸浸过程中反应的离子方程式:
 FeS2 +
FeS2 +  MnO2 +
MnO2 +  _____=
_____=  Mn2+ +
Mn2+ +  Fe2+ + S + SO42-+
Fe2+ + S + SO42-+  ____
____
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:________。(结合离子方程式解释)
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是__极(填“a”或“b”),生成EMD的电极反应式是_________。

(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:填空题
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物.工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-).
反应方程式为:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式_____________.
②氨水溶液中各元素原子的电负性从大到小排列顺序为_______________.
③醋酸分子中的两个碳原子,甲基(-CH3)碳和羧基(-COOH)碳的杂化方式分别是___________.
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________.
a.离子键 b.配位键 c.σ键 d.π键
(2)某离子型氢化物化学式为XY2,晶胞结构如图 所示,其中6个Y原子(○)用阿拉伯数字1~6标注.

①已知1、2、3、4号Y原子在晶胞上、下面上.则5、6号Y原子均在晶胞__________.(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______.a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
(3)一种铜合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为_____;若该晶体的晶胞参数为a pm,则该合金密度为______g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
查看答案和解析>>
科目: 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:推断题
塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料.添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害.其合成线路图如图I所示:
已知以下信息:①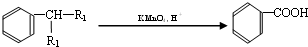
②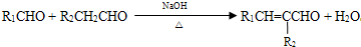 (-R1、R2表示氢原子或烃基)
(-R1、R2表示氢原子或烃基)
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图Ⅱ所示

(1)C的结构简式为______________,E中所含官能团的名称是______________;
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1:1反应生成F:______________;
②B和F以物质的量比1:2合成DBP:______________;该反应的反应类型为______________;
(3)同时符合下列条件的B的同分异构体有______________种,写出其中任意两种同分异构体的结构简式______________。
①不能和NaHCO3溶液反应
②能发生银镜反应
③遇FeC13溶液显紫色
④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com