
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. H2SiO3 SiO2
SiO2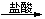 SiCl4 B. 浓HCl
SiCl4 B. 浓HCl Cl2
Cl2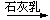 漂白粉
漂白粉
C. Fe Fe2O3
Fe2O3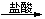 FeCl3 D. Mg(OH)2
FeCl3 D. Mg(OH)2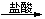 MgCl2(aq)
MgCl2(aq) 无水MgCl2
无水MgCl2
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符合的是

A. 图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g) CH3OH(g)。该反应的△H=-91.kJ·mol-1
CH3OH(g)。该反应的△H=-91.kJ·mol-1
B. 图乙表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂
C. 图丙表示向0.1 mol·L–1的氨水溶液中逐渐加水时溶液的导电性变化
D. 图丁表示盐酸滴加到0.1mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
真菌聚酮(X)具有多种生物活性,一定条件下可分别转化为Y和Z。
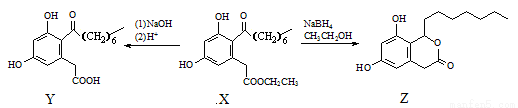
下列说法正确的是
A. X的分子式为:C18H26O5
B. X、Y和Z均能与Na2CO3溶液反应,且均有气体生成
C. X、Y和Z中均不含手性碳原子
D. 等物质的量的X、Y和Z分别与足量的NaOH溶液反应,消耗的NaOH溶液物质的量之比为1∶1∶1
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A. 通入过量的氨气:NH4+、SO42-、Na+、AlO2-
B. 加入过量NaHCO3溶液:SO42-、Na+、Al3+、HCO3-、Fe2+
C. 加入过量氯水: Cl-、SO42-、Fe3+、Al3+
D. 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+、Na+
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向PH=3的HA和HB溶液中分别加水稀释至100倍,pH(HA)>pH(HB) | 酸性:HA<HB |
B | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向FeBr2溶液中通入少量Cl2,溶液由浅绿色变为黄色 | 氧化性:Cl2>Br2 |
D | 向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
常温下,向10mL0.1mol·L-1H2A溶液中逐滴加入0.1mol·L-1NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示分析判断,下列微粒浓度大小关系正确的是

A. 当v=0时,c(H+)=c(OH-)+c(HA-)+c(A2-)
B. 当v=10时,c(Na+)=c(H2A)+c(HA-)+c(A2-)
C. 当v=20时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 当pH=7时,c(Na+)>c(HA-)+ c(A2-)
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
一定温度下,向3个初始体积均为1.0 L的密闭容器中按下表所示投料,发生反应N2(g)+3H2(g) 2NH3(g) △H<0达到平衡,下列说法错误的是
2NH3(g) △H<0达到平衡,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量/mol | 反应物的转化率 | 平衡时NH3的物质的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 绝热恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒温恒压 | 2 | 6 | 0 | α3 | b |
A. 达到平衡时,α1>α2
B. 平衡时NH3的物质的量b<2.4
C. 达到平衡时,容器Ⅱ中的反应速率比容器Ⅰ中的大
D. 保持温度不变,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol  NH3,平衡向正反应方向移动
NH3,平衡向正反应方向移动
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:
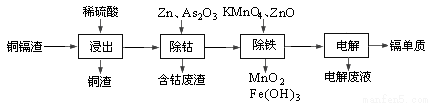
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
化合物H是合成植物生长调节剂赤霉酸的重要中间体,其合成路线如下:
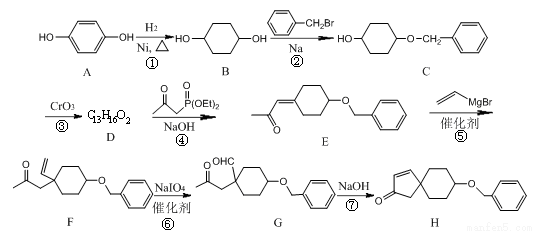
(1)化合物E的含氧官能团为______和______(填官能团的名称)。
(2)反应②的类型为__________。
(3)写出一种满足下列条件的C的同分异构体的结构简式____________。
I.分子含有1个苯环;
II.能发生银镜反应和水解反应;
III.分子有4种不同化学环境的氢。
(4)化合物C被氧化生成化合物D,D的结构简式为_______________。
(5)根据已有知识并结合相关信息,写出以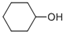 为有机原料制备
为有机原料制备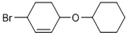 的合成路线流程图(无机试剂任用,可选择适当有机溶剂,合成路线流程图示例见本题题干)___________________。
的合成路线流程图(无机试剂任用,可选择适当有机溶剂,合成路线流程图示例见本题题干)___________________。
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
硫的化合物在生产生活中有广泛应用。
(1)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:
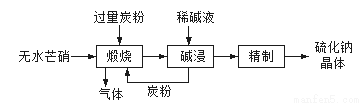
① 上述流程中采用稀碱液比用热水更好,理由是__________________。
② 取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)=______mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(2)工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3。KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用0.01000 mol·L?1 KIO3酸性标准溶液滴定至终点,消耗KIO3溶液31.25mL。
① 滴定终点观察到的现象为:_____________________。
② 成品中Na2SO3的质量分数是_________(请写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com