
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )
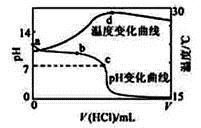
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O) > c(Cl-)
C. c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是 ( )
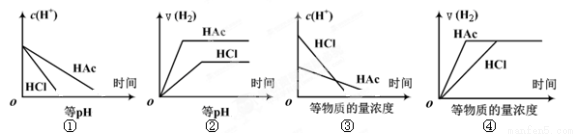
A. ①②③ B. ②④ C. ①③ D. ①②③④
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A. 0.4mol B. 0.5mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置。下列判断合理的是( )
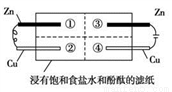
A. 左边铜片上有气泡冒出 B. 右边锌片上的反应为2Cl-- 2e-= Cl2↑
C. 最先观察到红色的区域是② D. 两铜片质量均不发生变化
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+ O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
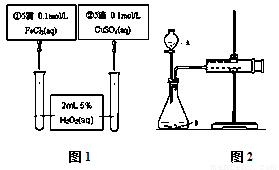
A. 图1实验可通过观察产生气泡快慢来比较反应速率的大小
B. 若图1所示实验中反应速率为①>②, 则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图2装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
A. ①、②、④溶液分别与足量铝粉反应,生成H2的量:②最少
B. 四种溶液的KW相同,由水电离的c(H+):①=③>②=④
C. 将①、④两种溶液混合后,若pH=7,消耗溶液的体积为:①>④
D. 向等体积的四种溶液中分别加入1000 mL水后,溶液的pH:③>④>②>①
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_____________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (选填“酸性”“中性”或“碱性”),理由是__________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为_____________________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应 ≥____________mol·L-1。
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.
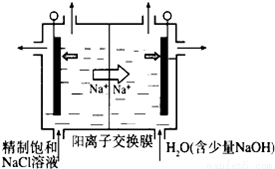
(1)①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________________.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为____mol;用平衡移动原理解释阴极区pH增大的原因___________。
(2)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为______;处理100m3这种污水,至少需要ClO2______mol.
(3)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为_________________。
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)?C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
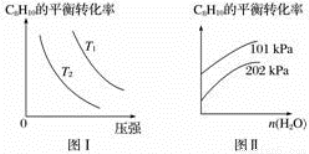
①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com