
科目: 来源:2017届湖南省邵阳市高三第二次大联考理综化学试卷(解析版) 题型:推断题
合成药物X 的路线如下:
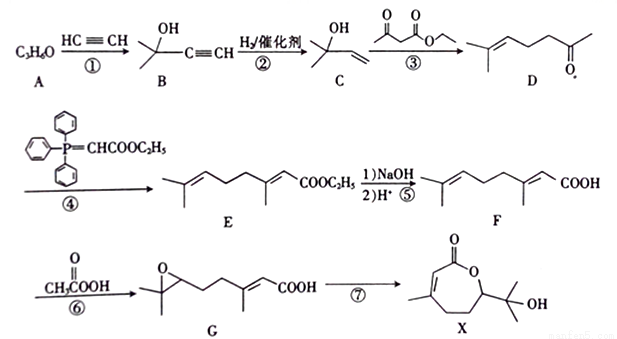
(1)X中含氧官能团的名称为________;A的核磁共振氢谱只有一组吸收峰,A的结构简式为____________。
(2)反应①的反应类型为_________。反应①还会得到另一产物H,其分子式为C8H14O2,写出H的结构简式:______________。
(3)反应⑥的产物为G和_________(填结构简式)。
(4)X分子消去一分子水可得物质J,同时满足下列条件的J的同分异构体共有_____种。其中核磁共振氢谱只有六组吸收峰的同分异构体与足量浓溴水反应的化学方程式为__________。
a.能与FeCl3溶液发生显色反应
b.能发生消去反应
c.苯环上只有2个取代基,且分子中只有2个甲基
(5)参照上述合成路线,设计一条以CH3OH、CH≡CH为原料制备聚丙烯醇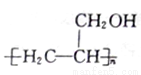 的合成路线图(无机试剂任用)。合成路线示例如下:_______________
的合成路线图(无机试剂任用)。合成路线示例如下:_______________
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
下面的“诗”情“化”意,分析正确的是
A. “粉身碎骨浑不怕,要留清白在人间”只发生了物理变化
B. “日照澄州江雾开”中伴有丁达尔效应
C. “试玉要烧三日满,辨材须待七年期”中“玉”的成分是硅盐酸,该句诗表明玉的硬度很大
D. “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,萄萄糖发生了水解反应
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 9 g超重水(3H216O)含中子数为6NA
B. 标准状况下,22.4 L CCl4含有的分子数目为NA
C. 常温常压下,16g甲烷中共价键数目为4NA
D. 1 L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸常共存在一起,其结构简式如图所示。下列说法正确的是
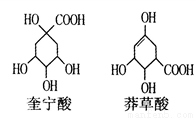
A. 奎宁酸与莽草酸互为同分异构体
B. 两种酸含有的官能团完全相同
C. 两种酸均能发生加成反应、聚合反应和取代反应
D. 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
短周期主族元素W、X、Y、Z的原子序数依次增大。W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半。下列叙述正确的是
A. 原子半径:Y>Z
B. 金属活动性:X<Y
C. 最简单氢化物的热稳定性:Z>W
D. Y元素的氧化物不溶于X元素最高价氧化物对应水化物的水溶液
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是
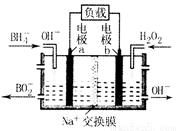
A. 电池的正极反应为H2O2+2e-==2OH-
B. 电池放电时Na+从a极区移向b极区
C. 电子从电极b经外电路流向电极a
D. b极室的输出液经处理后可输入a极室循环利用
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是
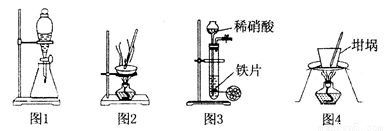
A. 用图1所示装置可以将乙醇和水分离
B. 用图2所示装置蒸发硫酸铜溶液制备硫酸铜晶体
C. 用图3所示装置通过稀硝酸与铁反应制取少量的氢气
D. 用图4所示装置分离氢氧化钙固体中混有的少量氯化铵固体
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
常温下,向1L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
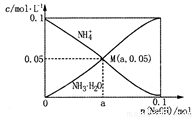
A. M点溶液中水的电离程度比原溶液大
B. a=0.05
C. 当n(NaOH)=0.05mol时溶液中有:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:实验题
过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
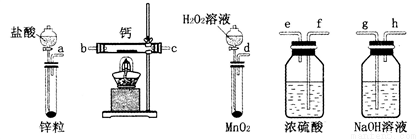
(1)请选择必要的装置,按气流方向连接顺序为____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后,________(填操作);④拆除装置,取出产物。
(3)若钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂, 设计实验检验钙的燃烧产物中是否含有过氧化钙________________。(简要说明实验步骤、现象和结论)
限选试剂:酸化的FeCl2溶液、NaOH溶液、KSCN溶液、稀硝酸
(4)利用反应Ca2++H2O2+2NH3+8H2O===CaO2·8H2O↓+2NH4+,在碱性环境下制取CaO2的装置如下:
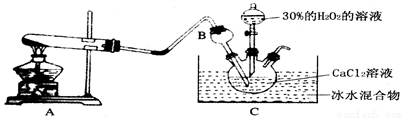
C中沉淀反应时常用冰水浴控制温度在0℃左右,其可能的原因分析:
该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
_______________ ______________。
(5)测定产品中CaO2含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的bg KI晶体,再滴入少量2mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3,溶液体积为V mL。
CaO2的质量分数为________(用字母表示)。[已知:I2+2S2O32-=2I-+S4O62-]
查看答案和解析>>
科目: 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:填空题
乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:___________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质), 电石与水反应生成C2H4(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的 热量,则该反应的热化学方程式为_____________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:4CuSO4+PH3+4H2O===4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③反应H2S(aq)+Cu2+(aq)===CuS(s)+2H+(aq)的平衡常数为________________;(已知Ksp(CuS)=1.25×10-36,H2S的Kal=1×10-7,Ka2=1×10-13)
④电石法工艺流程简单、容易操作、乙炔纯度高,缺点是_______(举1例)。
(3)甲烷裂解法原理为:2CH4(g) C2H2(g)+3H2(g)△H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如图所示:
C2H2(g)+3H2(g)△H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如图所示:
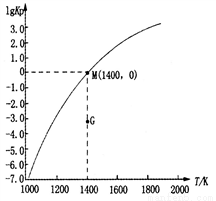
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,则总压P与n(CH4)、n(C2H2)及n(H2)之间的关系为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com