
科目: 来源:2017届四川省高三上学期第四次月考理科综合化学试卷(解析版) 题型:简答题
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti中,价电子排布式为 ____,价电子排布图为____
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3,实现储氢和输氢。下列说法正确的是_____ ;
2NH3,实现储氢和输氢。下列说法正确的是_____ ;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为__________,
SnBr2分子中 Sn-Br的键角______120°(填“>”“<”或“=”)。
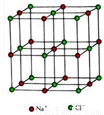
(4) NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是_______。
已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏加德罗常数的值, 则NiO 晶体的密度为_________g·cm-3。
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
化学与生活、科技关系密切。下列说法正确的是
A. 液氨可用作制冷剂是因为其气化时可放出大量的热
B. 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素
C. 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属
D. 久置的漂白粉变质是因为漂白粉与空气中的O2反应
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是
A. 30gNO和30gSiO2中含有的氧原子数均为NA
B. 0.5L2.0mol·L-1NaHSO3溶液中含有的HSO3-数目为NA
C. 标准状况下,5.6LN2与足量的H2反应生成NH3转移的电子数为1.5NA
D. 标准状况下,11.2LNH3与11.2LHCl混合后所得气体中分子数为NA
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精。下列有关该有机物的叙述正确的是
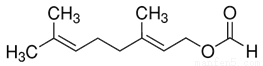
A. 分子式为C11H18O2 B. 含有羧基和碳碳双键两种官能团
C. 能发生加成反应和水解反应 D. 23gNa与过量的该物质反应生成标准状况下11.2L气体
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景。如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料。下列有关该镁燃料电池的叙述正确的是
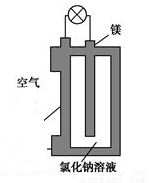
A. 该电池的总反应为2Mg+O2=2MgO
B. 反应生成O2-,该离子有正极移向负极
C. Cl-在阳极失去电子生成Cl2
D. 正极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
硫酸锶(SrSO4)可用于烟火和陶瓷工业,该物质是矿物天青石的主要成分,可有Na2SO4溶液加入锶盐溶液沉淀而得。如图是硫酸锶的溶解曲线,下列说法正确的是
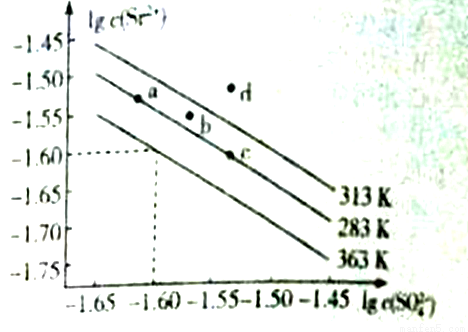
A. 图像中a、c两点的溶度积:Ksp(a)<Ksp(c)
B. 363K时的溶度积Ksp(SrSO4)=1.0×10-3.20
C. SrSO4的溶解度随温度升高而增大
D. 313K时,b点为饱和溶液,d点为不饱和溶液
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
W、X、Y、Z均为短周期主族元素,且原子序数依次增大。已知W元素的原子形成的离子是一个质子;X、Y在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;Z为同周期中原子半径最大的元素。下列有关说法正确的是
A. 四种元素均为非金属元素
B. W与X、Y形成的最简单分子的沸点:X>Y
C. Y、Z形成的化合物中只含离子键
D. W、Y、Z形成的化合物的电子式为
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
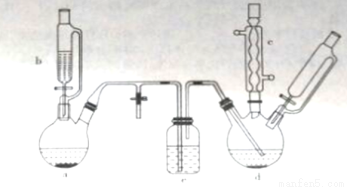
氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是__________,用离子方程式表示产生该现象的原因:_______________。
(2)仪器b外侧玻璃导管的作用是_____________。
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是_________,其盛装的试剂名称是_____________。
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是____________。
(4)仪器c的作用是______________。
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如下表:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集_________℃作用的馏分。
(6)实际工业生产中,苯的流失如下表:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13t苯,则制得氯苯________t(保留一位小数)。
查看答案和解析>>
科目: 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g)  CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数 (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g)  CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
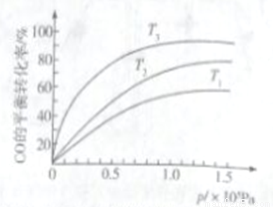
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com