
科目: 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:实验题
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目: 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:简答题
NO2与SO2能发生反应:NO2+SO2 SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g)  2NO2(g) △H=-113.0 kJ• mol-1
2NO2(g) △H=-113.0 kJ• mol-1
2SO2(g)+O2(g)  2SO3(g) △H=-196. 6 kJ• mol-1
2SO3(g) △H=-196. 6 kJ• mol-1
则NO2(g)+SO2(g)  SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。

③若A点对应实验中,S02(g)的起始浓度为c0 mol•L-1 ,经过t min达到平衡状态,该时段化学反应速率 (N02)= _________mol•L-1•min -1.
(N02)= _________mol•L-1•min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:简答题
碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
A.Te位于元素周期表的第五周期ⅣA族
B. Te的氧化物通常有TeO2和TeO3
C. H2TeO4的酸性比H2SO4酸性强
D.热稳定性H2Te比H2S弱,H2Te比HI强
(2)25℃时,亚碲酸(H2TeO3)的 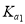 = 1×10-3,
= 1×10-3, 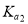 =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ ( ); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:

①“碱浸”时TeO2发生反应的化学方程式为 _________。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________;防止局部酸度过大的操作方法是____________。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________。
查看答案和解析>>
科目: 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:填空题
铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目: 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:推断题
链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:

已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应: (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F。
回答下列问题:
(1)A的结构简式为_____,A生成B的反应类型为_______。
(2)B生成C的化学方程式为_______。
(3)D的结构简式为_____,分子中最多有 __________个原子共平面。
(4)F的化学名称为_______。
(5)F的同分异构体中能同时满足下列条件的共有 ______种(不含立体异构);其中核磁共振氢谱显示为4组峰,且峰面积比为3 : 2 : 2 : 1的是_____; (写出其中一种的结构简式)。
①能与饱和NaHCO3溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
(6)聚乳酸( )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
下列说法正确的是
A. HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强
B. N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
C. 在O2、CO2和SiO2中,都存在共价键,它们均由分子构成
D. KOH和MgCl2都是离子晶体,均在共价键和离子键
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
化学学习中,推理是一种重要的学习方法,下列推论正确的是
A. 由“BF3和SO3互为等电子体”,可推知二者均为非极性分子
B. 由“同主族元素性质相似,CO2为直线形分子”,可推知SiO2为直线形分子
C. 由“SiH4的熔沸点比CH4高”,可推知PH3的熔沸点比NH3高
D. 由“C、N、O三种元素的电负性C<N<O”,可推知第一电离能C<N<O
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
元素周期表中, 某些主族元素与右下方的主族元素的性质具相似性, 这种规律被称为“对角线规则”。 下列叙述不正确的是
A. Li在N2中燃烧生成Li3N B. Li在空气中燃烧生成Li2O2
C. 可用NaOH 溶液分离 Mg(OH)2和Be(OH)2 D. 硼酸钠溶液显碱性
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
下列说法错误的是
A 冰中既存在范德华力,又存在氢键
B.简单立方是非密置层三维堆积形成的, 面心立方是由密置层三维堆积形成的
C.所有共价键都有方向性, 形成氢键的三个相关原子可以不在条直线上
D.金属晶体的导电、导热性都与自由电子有关, 离子晶体在一定条件下可以导电
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
有关晶体的结构如下图所示,下列说法中错误的是

A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子的分子式为EF或FE
C.在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻
D.在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com